Отек головного мозга патофизиология
Оглавление темы “Отек мозга. Первая помощь при отеке головного мозга. Миастения ( miastenia gravis pseudoparalitica ). Миастенический криз. Первая помощь при миастеническом кризе.”:
1. Отек мозга. Определение отека мозга. Причины ( этиология ) отека мозга. Патогенез отека мозга.
2. Клинические проявления отека головного мозга. Признаки отека мозга. Клиника отека мозга. Общемозговой синдром.
3. Синдром диффузного рострокаудального нарастания неврологических симптомов при отеке мозга. Дыхание Биота. Синдром дислокации мозговых структур.
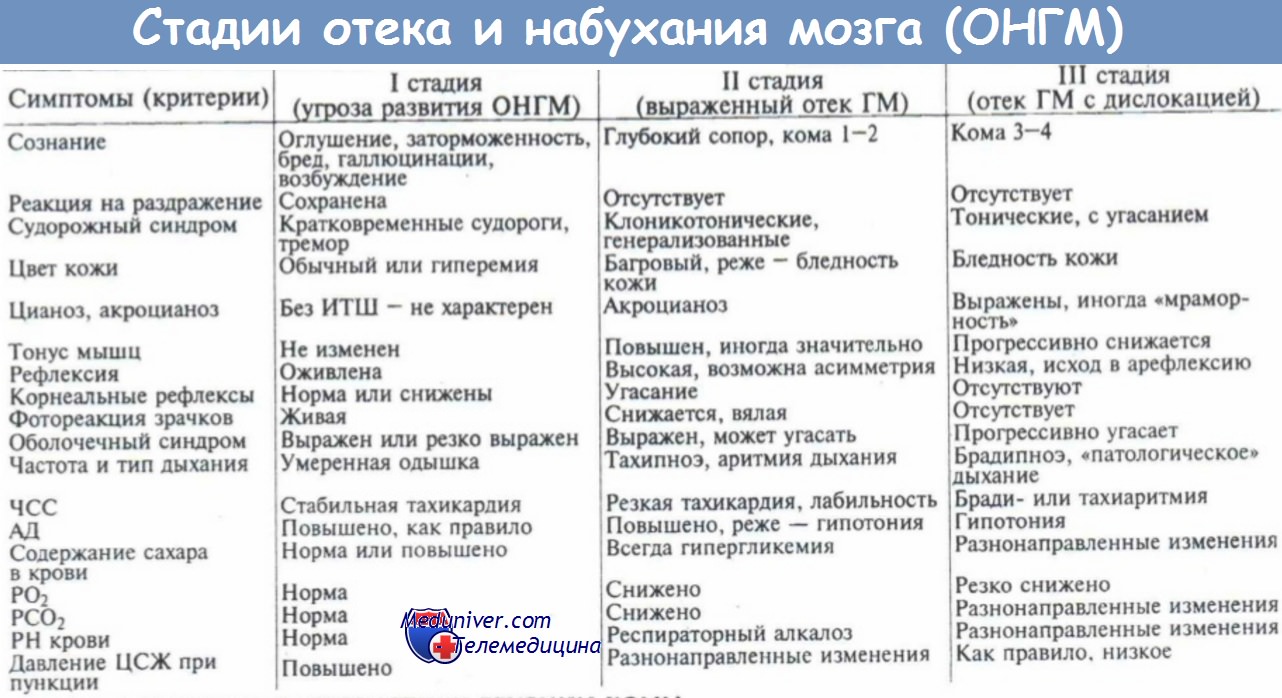
4. Диагностика отека головного мозга. Принципы лечения отека мозга.
5. Неотложная помощь при отеке мозга. Первая помощь при отеке головного мозга.
6. Лечение при отеке мозга. Лечение отека головного мозга в стационаре.
7. Миастения ( miastenia gravis pseudoparalitica ). Миастенический криз. Причины ( этиология ) миастении. Патогенез миастении.
8. Клиника ( признаки ) миастенического криза. Клиника ( признаки ) миастении. Диагностика миастении. Диагностика миастенического криза.
9. Неотложная помощь при миастеническом кризе. Первая помощь при миастеническом кризе.
Отек мозга. Определение отека мозга. Причины ( этиология ) отека мозга. Патогенез отека мозга.
Отеком мозга называется увеличение его объема вследствие накопления жидкости в межклеточном пространстве. Увеличение объема мозга за счет интрацеллюлярной жидкости называется набуханием. С точки зрения патофизиологии, данные состояния (отек и набухание) нередко могут развиваться одновременно и взаимно переходить друг в друга, поэтому с клинической точки зрения вполне допустимо оба эти понятия толковать как отек мозга.
Отек мозга относится к вторичным симптомам поражения. Он может быть местным (локальным, перифокальным) или генерализованным (диффузным).
Этиология отека мозга. Отек мозга возникает при многих заболеваниях, поражающих нервную систему: черепно-мозговая травма; инсульт; опухоли и абсцесс головного мозга; энцефалиты и менингиты; при гипоксии; при различных формах окклюзионной гидроцефалии; различных синдромах нарушения осмотического равновесия; общих интоксикациях; инфекциях; ожогах тела; злокачественной гипертонической болезни и др. В эксперименте и клинике доказано, что различные этиологические факторы вызывают патогенетически разные формы отека мозга, но механизмы его нарастания идентичны.

Патогенез отека мозга. Различают четыре типа отека мозга: вазогенный, цитотоксический, осмотический, гидростатический (А. Н. Коновалов, Б. А. Кодашев).
1. Вазогенный отек мозга связан с повышенной проницаемостью капилляров, вследствие чего жидкость из сосудов частично переходит в интерстициальное пространство (в толщу белого вещества), вызывая увеличение его объема. Вазогенные отеки обычно бывают перифокальными. Наиболее часто они наблюдаются при ЧМТ, опухолях мозга, инфекционно-аллергических поражениях ЦНС, геморрагических инсультах и др. (А. Н. Коновалов, Б. А. Кодашев, 1995).
2. Цитотоксический отек мозга возникает при токсическом (экзо- или эндогенном) воздействии на клетки головного мозга, в результате чего нарушается нормальный клеточный метаболизм и изменяется проницаемость клеточных мембран. Данный вид отека встречается при различных отравлениях и при ишемии мозга на фоне ишемического инсульта (А. Н. Коновалов, Б. А. Кодашев, 1995). Цитотоксический отек мозга обратим в течение 6—8 ч прежде всего за счет реактивации ионного насоса, которая может быть достигнута при восстановлении кровотока. Если это не происходит, отек приобретает вазогенный характер (Б. С. Виленский, 1986).
3. Осмотический отек развивается при нарушении существующего в норме небольшого осмотического градиента между осмо-лярностью ткани мозга (она выше) и осмолярностью плазмы. Данный вид развивается вследствие водной интоксикации ЦНС за счет гиперосмолярности мозговой ткани. Этот вид отека наблюдается при метаболических энцефалопатиях (почечная и печеночная недостаточность, гипергликемия и др.) (А. Н. Коновалов, Б. А. Кодашев, 1995).
4. Гидростатический отек обычно формируется при быстром повышении вентрикулярного давления. Накопление жидкости происходит в перивентрикулярной зоне, что четко выявляется при компьютерной томографии (А. Н. Коновалов, Б. А. Кодашев, 1995).
Учебное видео – анатомии ликворной системы и желудочков головного мозга
Скачать данное видео и просмотреть с другого видеохостинга можно на странице: Здесь.
– Также рекомендуем “Клинические проявления отека головного мозга. Признаки отека мозга. Клиника отека мозга. Общемозговой синдром.”
Источник
В акушерстве поражение мозга, как правило, наблюдается у больных, перенесших тяжелые формы гестоза, эклампсию, или в постреанимационном периоде тяжелого геморрагического, септического шока, других критических состояний.
Церебральный синдром развивается вследствие:
- структурных повреждений (при геморрагическом, ишемическом инсульте, абсцессе мозга);
- метаболических нарушений (в условиях гипоксии, гиперосмии, почечной, печеночной недостаточности, тяжелых электролитных нарушений);
- эндогенных интоксикаций (при сепсисе, перитоните).
Клиника церебральных нарушений включает такие неврологические симптомы, как парезы, судороги, нистагм, анизокорию, пирамидные и бульбарные знаки.
Общемозговая симптоматика определяется развитием отека мозга, проявляющегося нарушением сознания, аритмиями (как правило — брадикардией), патологическими ритмами дыхания, изменением картины на глазном дне — отеком соска зрительного нерва.
Тяжесть комы оценивается по шкале Глазго.
В литературе часто встречается термин «отек-набухание мозга». По мнению ряда авторов, эти два состояния — фазы одного процесса. При отеке мозга жидкость поступает из плазмы крови в результате повышения проницаемости ГЭБ и скапливается в межклеточном секторе. Эта жидкость бедна белком, но по ионному соотношению близка к плазме. При набухании вода связывается коллоидами клеток, и они увеличиваются в объеме — внутриклеточный отек. Первая форма получила еще название вазогенного отека, а вторая — цитотоксического (Devivo, Dogge, 1980).
По обширности процесса можно выделить местный отек (при кровоизлияниях в мозг, микротромбозах на фоне тяжелых форм гестоза) и генерализованный, охватывающий весь мозг (гипертензионная энцефалопатия, интоксикации, гиперкапния и гипоксия, постреанимационные состояния).
В патогенезе отека мозга ведущее значение приобретает нарушение проницаемости гемато-энцефалического барьера (ГЭБ) и мембран клеток мозга. Нарушение проницаемости может быть вызвано как экзогенным агентом, так и эндогенным, образующимся в самом организме. В этом плане весьма активными агентами являются кинины и простагландины (А. П. Зильбер, 1984). Нарушения обмена воды в мозге являются следствием недостаточности разнообразных осморегулирующих энергозависимых клеточных механизмов, в первую очередь, K-Na-Hacoca. Результатом нарушения осморегуляции является повышение осмолярности мозга, что влечет за собой перемещение жидкости из сосудистого русла в межклеточный и внутриклеточный секторы.
В свою очередь, повышение осмолярности мозга продиктовано недостаточностью окислительных процессов, приводящих к образованию Н+- ионов, пирувата, лактата (Todd M.V., Picozzi P., CrocKapd H. A., 1986). В настоящее время установлено, что в процессе развития отека мозга принимает активное участие олигодендроглия, обеспечивающая транспортировку жидкости в тканях головного мозга (Luce, 1961). В последующем отек мозга вызывает повышение внутричерепного давления, сдавление мелких церебральных сосудов и развитие вторичной ишемии нервной ткани.
Проведенные Э. Б. Сировским с соавт. (1990) многочисленные (более 3000) и разнообразные биохимические исследования у нейрохирургических больных с различной локализацией и выраженностью отека мозга показали, что в патогенезе его играет роль и специфический гормональный фон, определяемый, в основном, такими гормонами, как вазопрессин, альдостерон, ренин, ангиотензин. Отек мозга и повышение внутричерепного давления являются своеобразным стрессом, сопровождающимся выбросом АКТГ из аденогипофиза с последующей стимуляцией функции коры надпочечников, повышением концентрации альдостерона.
Кроме того, под действием симпат-адреналовой системы, которая также активируется при отеке мозга, происходит спазм сосудов почек и активация ренин-ангиотензин-альдостероновой системы. Другими словами, в организме больного с отеком мозга создаются условия для задержки натрия, воды и потери калия. В связи с этим, в остром периоде следует ограничиться от введения натрия, так как его достаточно и в депо организма, и в переливаемых плазмозаменителях, и в самой плазме, крови.
Корреляционный и факторный анализ биохимических данных показал, что зависимость отека мозга от тех или иных биохимических факторов в значительной степени связаны с уровнем поражения мозга. В то же время, ни одно, даже наиболее активное нейротропное биохимическое соединение, не может быть названо в качестве обязательного фактора развития отека мозга.
В генезе нарушений сосудистой проницаемости ГЭБ придается большое значение таким факторам, как низкое рO2 в крови и ткани мозга, увеличение концентрации водорода и углекислого газа (В. И. Салалыкин, А. И. Арутюнов, 1978). При острых воспалительных заболеваниях мозга, травме мозга или кровоизлияниях в мозг проницаемость ГЭБ настолько возрастает, что жидкая часть крови участвует в образовании отечной жидкости (Bakay, Lee, 1969).
Сегодня следует признать, что механизмы отека мозга остаются до конца не выясненными (А. М. Гурвич, 1969). Примером может служить наблюдаемый клиницистами феномен «третьего дня», когда спустя трое-четверо суток у больного с купированным отеком мозга вновь нарастают его явления, появляется выраженная симптоматика, сопровождающаяся ухудшением состояния (А. Э. Маневич, В. И. Салалыкин, 1977).
В патогенезе известного нейрохирургического «отека мозга 3-го дня» играют роль, по-видимому, аутоиммунные процессы (А. Э. Маневич, А. А. Потапов, 1976). В условиях нарушенного ГЭБ образуются антитела, которые, попадая из крови в ткань мозга, вызывают повреждение основных функций клетки, в том числе и осморегулирующих. Однако трудно объяснить, почему развитие отека мозга приходится на первые несколько суток после воздействия на мозг, в то время, как известно, что максимальное количество антител образуется значительно позже — на 14 — 21 сутки (В. И. Ратников, М. П. Бекер, 1980). Эта теория, по нашему мнению, хорошо объясняет так называемые отсроченные постреанимационные энцефалопатии.
Поражение центральной нервной системы может сопровождаться нарушением поведения, сознания, функций вегетативной нервной системы. Нарушения сознания могут быть от легкого сопора до глубокой комы.
Нарушения водно-солевого обмена при нейротоксикозе возникают в результате гипервентиляции, которая является компенсаторной реакцией на развитие метаболического ацидоза, возникающего в результате нарушения периферического кровообращения и шунто-диффузионных изменений в легких. Обычно гипервентиляция наблюдается в первой фазе нейротоксикоза.
Кроме того, дополнительные потери возникают вследствие повышения температуры (особенно при среднемозговой коме). Потеря воды, с одной стороны, сопровождается образованием эндогенной (оксидационной) воды, которая на фоне повышенной проницаемости переходит в интерстициальное, а затем и во внутриклеточное пространство. Нарушение осморегулирующих механизмов клетки, K-Na – насоса приводят к задержке воды в клетке и интерстиции и формированию отека-набухания мозга.
Лысенков С.П., Мясникова В.В., Пономарев В.В.
Неотложные состояния и анестезия в акушерстве. Клиническая патофизиология и фармакотерапия
Опубликовал Константин Моканов
Источник
1. Amiry-Moghaddam M., Otsuka T., Hurn P. D., Traystman R. J., Haug F. M., Froehner S. C., Adams M. E., Neely J. D., Agre P., Ottersen O. P., Bhardwaj A. An alpha-syntrophin-dependent pool of AQP4 in astroglial end-feet confers bidirectional water flow between blood and brain // Proc. Natl. Acad. Sci USA. – 2003. – Vol. 100, № 4. – Р. 2106–2111.
2. Bell B. A., Symon L., Branston N. M. CBF and time thresholds for the formation of ischemic cerebral edema, and effect of reperfusion in baboons // J. Neurosurg. – 1985. – Vol. 62, № 1. – Р. 31–41.
3. Castejón O. J. Increased vesicular and vacuolar transendothelial transport in traumatic human brain oedema. A review // Folia Neuropathol. – 2013. – Vol. 51, № 2. – Р. 93–102.
4. Chen H., Luo J., Kintner D. B., Shull G. E., Sun D. Na+-dependent chloride transporter (NKCC1)-null mice exhibit less gray and white matter damage after focal cerebral ischemia // J. Cereb. Blood Flow Metab. – 2005. – Vol. 25, № 1. – Р. 54–66.
5. Chen H., Sun D. The role of Na-K-Cl co-transporter in cerebral ischemia // Neurol Res. – 2005. – Vol. 27, № 3. – Р. 280–286.
6. Crompton E. M., Lubomirova I., Cotlarciuc I., Han T. S., Sharma S. D., Sharma P. Meta-analysis of therapeutic hypothermia for traumatic brain injury in adult and pediatric patients // Crit. Care Med. – 2017. – Vol. 45, № 4. – Р. 575–583.
7. Durward Q. J., Del Maestro R. F., Amacher A. L., Farrar J. K. The influence of systemic arterial pressure and intracranial pressure on the development of cerebral vasogenic edema // J. Neurosurg. – 1983. – Vol. 59, № 5. – Р. 803–809.
8. Elfeber K., Köhler A., Lutzenburg M., Osswald C., Galla H. J., Witte O. W., Koepsell H. Localization of the Na+-D-glucose cotransporter SGLT1 in the blood-brain barrier // Histochem Cell Biol. – 2004. – Vol. 121, № 3. – Р. 201–207.
9. Ferrazzano P., Shi Y., Manhas N., Wang Y., Hutchinson B., Chen X., Chanana V., Gerdts J., Meyerand M. E., Sun D. Inhibiting the Na+/H+ exchanger reduces reperfusion injury: a small animal MRI study // Front Biosci (Elite Ed). – 2011. – Vol. 3. – Р. 81–88.
10. Fischer S., Wobben M., Marti H. H., Renz D., Schaper W. Hypoxia-induced hyperpermeability in brain microvessel endothelial cells involves VEGF-mediated changes in the expression of zonula occludens-1 // Microvasc. Res. – 2002. – Vol. 63, № 1. – Р. 70–80.
11. Fukuda S., Fini C. A., Mabuchi T., Koziol J. A., Eggleston L. L. Jr., del Zoppo G. J. Focal cerebral ischemia induces active proteases that degrade microvascular matrix // Stroke. – 2004. – Vol. 35, № 4. – Р. 998–1004.
12. Gerzanich V., Woo S. K., Vennekens R., Tsymbalyuk O., Ivanova S., Ivanov A., Geng Z., Chen Z., Nilius B., Flockerzi V., Freichel M., Simard J. M. De novo expression of Trpm4 initiates secondary hemorrhage in spinal cord injury // Nat. Med. – 2009. – Vol. 15, № 2. – Р. 185–191.
13. Haj-Yasein N. N., Vindedal G. F., Eilert-Olsen M., Gundersen G. A., Skare Ø., Laake P., Klungland A., Thorén A. E., Burkhardt J. M., Ottersen O. P., Nagelhus E. A. Glial-conditional deletion of aquaporin-4 (Aqp4) reduces blood-brain water uptake and confers barrier function on perivascular astrocyte endfeet // Proc. Natl. Acad Sci USA. – 2011. – Vol. 108, № 43. – Р. 17815–17820.
14. Hamann G. F., del Zoppo G. J., von Kummer R. Hemorrhagic transformation of cerebral infarction-possible mechanisms // Thromb Haemost. – 1999. – Vol. 82 Suppl. 1. – Р. 92–94.
15. Hansson E., Muyderman H., Leonova J., Allansson L., Sinclair J., Blomstrand F., Thorlin T., Nilsson M., Rönnbäck L. Astroglia and glutamate in physiology and pathology: aspects on glutamate transport, glutamate-induced cell swelling and gap-junction communication // Neurochem. Int. – 2000. – Vol. 37, № 2–3. – Р. 317–329.
16. Hirt L., Price M., Ternon B., Mastour N., Brunet J. F., Badaut J. Early induction of AQP4 contributes the limitation of the edema formation in the brain ischemia // J. Cereb. Blood Flow Metab. – 2009. – Vol. 29. – Р. 423–433.
17. Hofmeijer J., Schepers J., Veldhuis W. B., Nicolay K., Kappelle L. J., Bär P. R., van der Worp H. B. Delayed decompressive surgery increases apparent diffusion coefficient and improves peri-infarct perfusion in rats with space-occupying cerebral infarction // Stroke. – 2004. – Vol. 35, № 6. – Р. 1476–1481.
18. Klatzo I. Presidental address. Neuropathological aspects of brain edema // J. Neuropathol. Exp. Neurol. – 1967. – Vol. 26, № 1. – Р. 1–14.
19. Laposata M., Dovnarsky D. K., Shin H. S. Thrombin-induced gap formation in confluent endothelial cell monolayers in vitro // Blood. – 1983. – Vol. 62, № 3. – Р. 549–556.
20. Lu K. T., Huang T. C., Tsai Y. H., Yang Y. L. Transient receptor potential vanilloid type 4 channels mediate Na-K-Cl-co-transporter-induced brain edema after traumatic brain injury // J. Neurochem. – 2017. – Vol. 140, № 5. – Р. 718–727.
21. Monro S. A. Observations on the structure and function of the nervous system. Edinburgh: W Creech, – 1783. – P. 2–8.
22. Mori K., Nakao Y., Yamamoto T., Maeda M. Early external decompressive craniectomy with duroplasty improves functional recovery in patients with massive hemispheric embolic infarction: timing and indication of decompressive surgery for malignant cerebral infarction // Surg. Neurol. – 2004. – Vol. 62, № 5. – Р. 420–429.
23. Nag S., Kapadia A., Stewart D. J. Review: molecular pathogenesis of blood-brain barrier breakdown in acute brain injury // Neuropathol Appl. Neurobiol. – 2011. – Vol. 37, № 1. – Р. 3–23.
24. O’Donnell M. E., Tran L., Lam T. I, Liu X. B., Anderson S. E. Bumetanide inhibition of the blood-brain barrier Na-K-Cl cotransporter reduces edema formation in the rat middle cerebral artery occlusion model of stroke // J. Cereb. Blood. Flow Metab. – 2004. – Vol. 24, № 9. – Р. 1046–1056.
25. Papadopoulos M. C., Verkman A. S. Aquaporin-4 gene disruption in mice reduces brain swelling and mortality in pneumococcal meningitis // J. Biol. Chem. – 2005. – Vol. 280, № 14. – Р. 13906–13912.
26. Piazza M., Munasinghe J., Murayi R., Edwards N., Montgomery B., Walbridge S., Merrill M., Chittiboina P. Simulating vasogenic brain edema using chronic VEGF infusion // J. Neurosurg. – 2017. – Vol. 6. – Р. 1–12.
27. Rao K. V., Reddy P. V., Curtis K. M., Norenberg M. D. Aquaporin-4 expression in cultured astrocytes after fluid percussion injury // J. Neurotrauma. – 2011. – Vol. 28, № 3. – Р. 371–381.
28. Reichardt M. Hirnschwellung // Allg. Z. Psychiatr. – 1919. – Vol. 75. – Р. 34–103.
29. Ren Z., Iliff J. J., Yang L., Yang J., Chen X., Chen M. J., Giese R. N., Wang B., Shi X., Nedergaard M. ‘Hit & Run’ model of closed-skull traumatic brain injury (TBI) reveals complex patterns of post-traumatic AQP4 dysregulation // J. Cereb. Blood. Flow Metab. – 2013. – Vol. 33. – Р. 834–845.
30. Saadoun S., Papadopoulos M. C., Watanabe H., Yan D., Manley G. T., Verkman A. S. Involvement of aquaporin-4 in astroglial cell migration and glial scar formation // J. Cell. Sci. – 2005. – Vol. 118. – Р. 5691–5698.
31. Simard J. M., Yurovsky V., Tsymbalyuk N., Melnichenko L., Ivanova S., Gerzanich V. Protective effect of delayed treatment with low-dose glibenclamide in three models of ischemic stroke // Stroke. – 2009. – Vol. 40, № 2. – Р. 604–609.
32. Solenov E., Watanabe H., Manley G. T., Verkman A. S. Sevenfold-reduced osmotic water permeability in primary astrocyte cultures from AQP-4-deficient mice, measured by a fluorescence quenching method // Am. J. Physiol. Cell. Physiol. – 2004. – Vol. 286, № 2. – Р. 426–432.
33. Song L., Pachter J. S. Monocyte chemoattractant protein-1 alters expression of tight junction-associated proteins in brain microvascular endothelial cells // Microvasc. Res. – 2004. – Vol. 67, № 1. – Р. 78–89.
34. Stokum J. A., Gerzanich V., Simard J. M. Molecular pathophysiology of cerebral edema // J. Cereb. Blood. Flow Metab. – 2016. – Vol. 36, № 3. – Р. 513–538.
35. Stokum J. A., Kurland D. B., Gerzanich V., Simard J. M. Mechanisms of astrocyte-mediated cerebral edema // Neurochem. Res. – 2015. – Vol. 40, № 2. – Р. 317–328.
36. Su G., Kintner D. B., Flagella M., Shull G. E., Sun D. Astrocytes from Na+-K+-Cl- cotransporter-null mice exhibit absence of swelling and decrease in EAA release // Am. J. Physiol. Cell. Physiol. – 2002. – Vol. 282, № 5. – Р. 1147–1160.
37. Suzuki Y., Matsumoto Y., Ikeda Y., Kondo K., Ohashi N., Umemura K. SM-20220, a Na+/H+ exchanger inhibitor: effects on ischemic brain damage through edema and neutrophil accumulation in a rat middle cerebral artery occlusion model // Brain. Res. – 2002. – Vol. 945, № 2. – Р. 242–248.
38. Tao-Cheng J. H., Brightman M. W. Development of membrane interactions between brain endothelial cells and astrocytes in vitro // Int. J. Dev. Neurosci. – 1988. – Vol. 6, № 1. – Р. 25–37.
39. Thrane A. S., Rangroo Thrane V., Nedergaard M. Drowning stars: reassessing the role of astrocytes in brain edema // Trends Neurosci. – 2014. – Vol. 37, № 11. – Р. 620–628.
40. Tourdias T., Mori N., Dragonu I., Cassagno N., Boiziau C., Aussudre J., Brochet B., Moonen C., Petry K. G., Dousset V. Differential aquaporin 4 expression during edema build-up and resolution phases of brain inflammation // J. Neuroinflammation. – 2011. – Vol. 8. – Р. 143.
41. Whytt R. Observations on the Dropsy in the brain. Edinburgh: J. Balfour, 1768. P. 49–95.
42. Xu M., Su W., Xu Q. P. Aquaporin-4 and traumatic brain edema // Clin J Traumatol. – 2010. – Vol. 13, № 2. – Р. 103–110.
43. Yamagata K., Tagami M., Takenaga F., Yamori Y., Itoh S. Hypoxia-induced changes in tight junction permeability of brain capillary endothelial cells are associated with IL-1beta and nitric oxide // Neurobiol. Dis. – 2004. – Vol. 17, № 3. – Р. 491–499.
44. Yan Y., Dempsey R. J., Flemmer A., Forbush B., Sun D. Inhibition of Na+-K+-Cl- cotransporter during focal cerebral ischemia decreases edema and neuronal damage // Brain. Res. – 2003. – Vol. 961, № 1.– Р. 22–31.
45. Yang B., Zador Z., Verkman A. S. Glial cell aquaporin-4 overexpression in transgenic mice accelerates cytotoxic brain swelling // J. Biol. Chem. – 2008. – Vol. 283. – Р. 15280–15286.
46. Yang Y., Estrada E. Y., Thompson J. F., Liu W., Rosenberg G. A. Matrix metalloproteinase-mediated disruption of tight junction proteins in cerebral vessels is reversed by synthetic matrix metalloproteinase inhibitor in focal ischemia in rat // J. Cereb. Blood. Flow Metab. – 2007. – Vol. 27, № 4. – Р. 697–709.
Источник
