Каррагениновый отек у крыс
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Русских И.С.
1
Черемных А.И.
1
1 ФГБОУ ВО Пермский государственный медицинский университет им. Акад. Е.А.Вагнера Минздрава России
Впервые в 1958 г. Арон Лернер из Йельского университета (США) выделил из эпифиза быка, изучил и описал структуру мелатонина (N-ацетил-5-метокситриптамин). Эта биологически важная молекула впоследствии была найдена в сетчатке глаза, клетках костного мозга, кишечника и кожи. Существует ряд клинических и экспериментальных данных о влиянии мелатонина на различные патологические состояния, связанные с воспалением. Среди них воспалительные поражения суставов, внутренних органов (например, язвенный колит), периферических нервов. Следует сразу подчеркнуть, что такие факты не всегда однозначно указывают на клиническую эффективность препарата. Целью нашего исследования стало определение противовоспалительной активности мелатонина на модели «каррагенинового» отека лапы у крыс. Острую воспалительную реакцию (отек) воспроизводили субплантарным (под подошвенный или плантарный апоневроз) введением 0,1 мл 1% раствора каррагенина (сульфатированный полисахарид из ирландского морского мха). Выраженность воспалительной реакции оценивали через 3, 12 часов после индукции воспаления по изменению объема лапы (онкометрически). Исследуемые вещества наносили на лапы крыс в виде мази. Противовоспалительный эффект, оцениваемый по уменьшению отека, выражали в процентах по отношению к контролю. По результатам исследования на основании данных онкометрических измерений при индукции «каррагенинового» отека лап у крыс показано, что мелатонин обладает выраженным противовоспалительным действием.
мелатонин
воспаление
клиническое исследование
каррагениновый отек
противовоспалительный эффект
1. Верин, В. К. Гормоны и их эффекты / В.К. Верин, В.В. Иванов. – М.: Фолиант, 2011. – 136 c.
2. Миронов, А.Н. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. – М.: Гриф и К, 2012. – 944 с.
3. Melatonin: a hormone, a tissue factor, an autocoid, a paracoid, and an antioxidant vitamin / D. X. Tan// J. Pineal. Res. – 2003. – Vol. 34,ol. №1. – P.75-78.
4. Melatonin cytotoxicity in human leukemia cells: relation with its pro-oxidant effect / M. Buyukavei// Fundam. Clin. Pharmacol. – 2006. – Vol. 20, №1. – P. 73-79.
5. Zimecki, M. The lunar cycle: effects on human and animal behavior and physiology / M. Zimecki// Postepy Hig. Med. Dosw. (Online). – 2006. – № 60. – P.1-7.
Впервые в 1958 г. Арон Лернер из Йельского университета (США) выделил из эпифиза быка, изучил и описал структуру мелатонина (N-ацетил-5-метокситриптамин) (рис.1). Эта биологически важная молекула впоследствии была найдена в сетчатке глаза, клетках костного мозга, кишечника и кожи. Изначально мелатонин считался гормоном, участвующим в синхронизации механизмов циркадного ритма в организме.
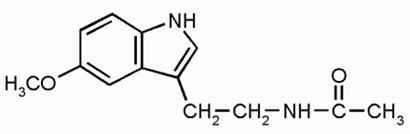
Рис.1 Структурная формула мелатонина
Позже было установлено, что кроме этой гормональной функции он принимает участие в регуляции сезонного и лунного циклов у животных и человека. Кроме того, он является тканевым фактором и одним из самых мощных и доступных эндогенных антиоксидантов и регуляторов иммунной системы. Если учесть, что мелатонин синтезируется также лимфоцитами, а рецепторы мелатонина найдены в мембранах тимоцитов, это дополнительно свидетельствует о значительном влиянии на функцию иммунной системы [5].
В организме человека мелатонин принимает участие в формировании многих патологических событий, включая канцерогенез и старение, когда отмечается снижение уровня данного гормона. Кроме того, уровень мелатонина в крови снижен у хронических курильщиков и у людей с повышенным индексом массы тела.
Свойства мелатонина:
· снижается температура тела;
· уменьшается уровень стрессовых гормонов и эмоциональное напряжение;
· возникает сонливость, наступает сон;
· падает давление крови, замедляется ритм сердечных сокращений;
· расслабляются мышцы;
· тормозится работа органов пищеварения и половой системы;
· восстанавливаются обменные процессы в головном мозге, происходит обработка информации, полученной за день.
Концентрация гормона достигает максимума к полуночи, держится на высоком уровне до 5 часов утра. Максимальные показатели гормона в детском возрасте, затем в период полового созревания они снижаются и вновь возрастают у молодых людей 20-23 лет. После 50 лет начинается прогрессивное уменьшение синтеза гормона и к 65 годам его в крови содержится на 20% меньше, чем у 45-летних [1].
Локальная мелатонинергическая система обнаружена в коже животных и человека. Мелатонин кожи участвует в процессах роста и пигментации волос, защищает клетки от воздействия ультрафиолета и других экзогенных и эндогенных повреждающих факторов.
Созданный в качестве фармакологического препарата мелатонин обнаружил необычайно широкий диапазон лечебных возможностей, которые оказались востребованы при различных патологических состояниях головного мозга и внутренних органов. Многие из них (церебральный отек, поражения желудочно-кишечного тракта, болевой синдром и др.) неизменно сопровождает воспаление, ограничение которого могло бы служить одной из целей терапевтического воздействия мелатонина. Это обстоятельство побудило обобщить факты, свидетельствующие и наличии у мелатонина противовоспалительных свойств, а также изучить данные свойства в ходе эксперимента [3].
Противовоспалительные возможности мелатонина
Способность мелатонина ограничивать воспалительный процесс определяется, по-видимому, совокупностью механизмов, имеющих как регионарное, так и системное происхождение. К числу местных факторов можно отнести прямое влияние мелатонина на отдельные компоненты воспалительной реакции, изменение иммунной реактивности и ограничение оксидантного стресса.
Одним из важнейших элементов антиэкссудативного действия мелатонина следует признать его вмешательство в каскад арахидоновой кислоты с нарушением синтеза простагландинов. Этот факт был установлен в опытах in vitro еще в начале 80-х годов прошлого века. Уже тогда обращалось внимание, с одной стороны, на сходство ингибиторных эффектов мелатонина и индометацина, а с другой – на вероятность их реализации в мозговой ткани (медиобазальном гипоталамусе) крыс [3,4].
Позднее на модели провоцируемой липосахаридом гипертермии и активации макрофагов было показано, что противовоспалительная активность мелатонина не зависит от непосредственного влияния на простогландиновые рецепторы, но определяется угнетением функции фермента циклооксигеназы (ЦОГ), индуцибельная изоформа которой – ЦОГ-2, являясь ключевым этапом в биосинтезе простогландинов, играет, как известно, критическую роль в воспалительном ответе при разных формах патологии.
Синтез индольного соединения мелатонина в секреторных клетках шишковидной железы – пинеалоцитах – происходит в несколько этапов. Исходным звеном является триптофан, который через серотонин и N-ацетилсеротонин превращается в конечный гормон. Ключевыми ферментами синтеза являются N-ацетилтрансфераза и гидроксииндол-O-метилтрансфераза. Образующийся мелатонин секретируется главным образом в спинномозговой жидкости, из которой он попадает в сосудистое русло, а затем переносится по всему организму кровотоком. В структурах головного мозга и периферических органах действие гормона осуществляется через специфические рецепторы (в основном, типов MT1 и MT2) [5].
Показательно, что образование эпифизарного мелатонина, вне в зависимости от видовых особенностей животных, максимально выражено в темноте и минимально на свету. Это обстоятельство дает основание рассматривать шишковидную железу как важную хронотропную железу, которая благодаря тесным морфофункциональным связям с драйвером циркадного ритма – супрахтмическими ядрами гипоталамуса – циркадными колебаниями различных физиологических функций. Учитывая факт преобладающей секреции мелатонина в темноте, они стали приписывать непосредственный интерес формированию цикла сна-бодрствования. В результате мелатонин приобрел репутацию естественного организатора биологических ритмов – хронобиотика и природного гипногенного агента.
В 70-е годы минувшего века иммуногистохимическая техника позволила установить наличие наряду с эпифизарным собственного мелатонина в различных периферических тканях. Содержащие его, в большинстве своем энтерохромаффинные, клетки принадлежат к ряду апудоцитов и наиболее полно представлены в различных элементах желудочно-кишечного тракта [4].
Как и в эпифизе, внеэпифизарный мелатонин проходит аналогичные этапы синтеза при участии тех же ферментов. Знаменательно, что его общее количество в ткани этих органов в десятки раз превосходит уровень плазменного мелатонина эпифизарного происхождения. После удаления эпифиза исчезают суточные колебания содержания гормона в плазме крови, но за счет периферических клеточных элементов в дневные часы он продолжает в определенном количестве удерживаться в сосудистом русле.
Влияние мелатонина на воспалительный процесс
Существует ряд клинических и экспериментальных данных о влиянии мелатонина на различные патологические состояния, связанные с воспалением. Среди них воспалительные поражения суставов, внутренних органов (например, язвенный колит), периферических нервов. Следует сразу подчеркнуть, что такие факты не всегда однозначно указывают на клиническую эффективность препарата [3,5].
Прежде всего, по наблюдениям отдельных исследователей, повторное введение препаратов мелатонина пациентам с ревматоидным артритом может успешно дополнить базовую терапию и повысить ее эффективность. Так, при ежедневном применении (3 мг в сутки) описано более выраженное ослабление утренней скованности, уменьшение количества опухших и болезненных суставов. Клиническое улучшение коррелировало с нормализацией ночного сна и перестройкой ритма суточной секреции кортизола. При более высокой дозе (10 мг) мелатонин наряду с некоторым ограничением симптомов ревматоидного артрита значительно оптимизировал антиоксидантный статус у пациентов. Многочисленная информация также представлена ??о способности мелатонина (3-6 мг) снимать головные боли различного происхождения. У людей и животных мелатонин также ограничивал ототоксическое действие аминогликозидных антибиотиков, оптимизировал лечение пациентов с ожогами, а при длительном (6-12 месяцев) применении улучшал состояние пациентов с язвенным колитом. В то же время имеются данные о способности мелатонина в некоторых случаях обострять течение ревматоидного артрита у пациентов и при его экспериментальном моделировании на животных [5].
Учитывая преобладание информации, указывающей на ограничение воспалительных проявлений мелатонина, вводимого извне, следует признать, что важно искать связь между уровнем эндогенного мелатонина и выраженностью симптомов. Однако результаты этого поиска еще не дают однозначных выводов. Согласно одной информации, радиоиммунное определение уровня гормонов плазмы у пациентов с ревматоидным артритом в ночное время указывает на снижение его значения по сравнению со здоровыми людьми, и, согласно другим данным, ревматоидный артрит и анкилозирующий спондилит, напротив, сопровождаются, напротив, увеличение секреторной активности шишковидной железы. Однако есть указание на то, что при патологии, в отличие от нормы, кривая суточной выработки мелатонина выглядит иначе, поскольку пик его содержания в плазме смещается вперед на несколько часов. Однако защитный, адаптивный характер эпифизарной гиперактивности в ответ на первичное воспалительное поражение не исключен.
Цель исследования:
Определение противовоспалительной активности мелатонина на модели «каррагенинового» отека лапы у крыс.
Материалы и методы
Изучение противовоспалительной активности мелатонина проводили на модели «каррагениновый отёк лапы» у крыс. Эксперименты выполнены на 30 белых неинбредных крысах средней массой 325,97±1,2 г. Подопытных животных содержали в условиях вивария (с естественным режимом освещения; при температуре 22–24; относительной влажности воздуха 40–50 %) с использованием стандартной диеты (ГОСТ Р 50258-92). Исследования проводили в соответствии с правилами качественной лабораторной практики (GLP) при проведении доклинических исследований в РФ, а также правилами и Международными рекомендациями Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1986).
Противовоспалительную активность мелатонина оценивали в экспериментах на модели «каррагенинового» отека лапы. Острую воспалительную реакцию (отек) воспроизводили субплантарным (под подошвенный или плантарный апоневроз) введением 0,1 мл 1% раствора каррагенина (сульфатированный полисахарид из ирландского морского мха) [2]. Выраженность воспалительной реакции оценивали через 3, 12 часов после индукции воспаления по изменению объема лапы (онкометрически). Исследуемые вещества наносили на лапы крыс в виде мази. Противовоспалительный эффект, оцениваемый по уменьшению отека, выражали в процентах по отношению к контролю.
В качестве исследуемого вещества был выбран мелатонин в составе двух препаратов: Мелатонин + L-теанин 200 мг (Производитель: Nature Made) и Мелаксен (Производитель: Юнифарм) . Исследуемые вещества наносили на лапы крыс в виде мази, изготовляемой непосредственно перед экспериментом путем добавления измельченных препаратов к мазевой основе (10% раствор Натрий –КМЦ). Препаратом сравнения был выбран Диклофенак– стандартное НПВС.
Подопытные животные были разделены на 4 группы (по 6 крыс в каждой):
1) Крысы, получавшие Мелатонин с теанином в дозе 10 мг/мл – 0,1 мл;
2) Крысы, получавшие Мелаксен в дозе 10 мг/мл – 0,1 мл;
3) Крысы, получавшие Диклофенак в дозе 10 мг/мл – 0,1 мл;
4) Крысы контрольной группы
Результаты
Было выявлено, что при субплантарном введении 0,1 мл 1 % раствора каррагенина у подопытных крыс развивается выраженный отек лапы, о чем свидетельствует достоверное увеличение ее объема. Отмечено, что максимальный отёк лапки (пик воспаления) развивался через 3 часа после введения каррагенина, при этом объем лапы у подопытных животных контрольной группы увеличивался в среднем на 82,5 %±5,7%.
При нанесении НПВС Диклофенака показатель прироста объема лапы составил 28,33±5,4% через 3 часа после индукции воспаления и нанесения препарата по сравнению с фоновым значением. При нанесении препаратов мелатонина это значение составило в среднем 52,08±7,7%. Также были найдены достоверные отличия между мелатонинсодержащими препаратами: прирост объема лапы крысы при применении Мелатонина с L-теанином составил 63,33±5,4%, Мелаксена – 40,83±9,9%.
При онкометрическом измерении объема лап крыс через 12 часов после индукции воспаления и нанесения препаратов достоверно наблюдалось уменьшение объема лап крыс по сравнению с измерениями через 3 часа после индукции воспаления: при нанесении Диклофенака на 15,33±2,4%; мелатонинсодержащих препаратов – на 23,33±5,6% в среднем. Причем показатели мелатонинсодержащих препаратов достоверно отличались между собой, при нанесении Мелатонина с L-теанином объем лап крыс уменьшился на 26,63±5,8%, при нанесении Мелаксена – на 20,03±5,3%.
Показатели объема лапы крыс в мл. (Таблица №1):
Название препарата | Объем лапы крысы, мл. | ||
Фон | Через 3 часа | Через 12 часов | |
Мелатонин+теанин | 0,96 | 1,59 | 1,33 |
Мелаксен | 0,92 | 1,33 | 1,13 |
Диклофенак | 0,98 | 1,27 | 1,08 |
Контрольная группа | 1,06 | 1,88 | 1,23 |
Таб.1 Объемы лап крыс
Прирост объема лапы крысы в процентном отношении (Таблица №2):
Название препарата | Прирост объема лапы крысы, % | |
Через 3 часа | Через 12 часов | |
Мелатонин+теанин | 63,33 | 36,70 |
Мелаксен | 40,83 | 20,80 |
Диклофенак | 28,33 | 13,00 |
Контрольная группа | 82,50 | 17,50 |
Таб.2 Прирост объема лапы в процентном отношении
Показатели объема лапы крыс в процентном отношении (Диаграмма №1):
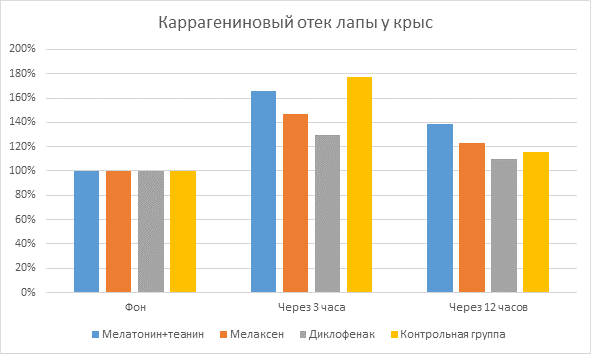
Диаграмма 1. Показатели объема лапы крыс в %
Выводы: на основании данных онкометрических измерений при индукции «каррагенинового» отека лап у крыс показано, что мелатонин обладает выраженным противовоспалительным действием.
Библиографическая ссылка
Русских И.С., Черемных А.И. ИССЛЕДОВАНИЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ АКТИВНОСТИ МЕЛАТОНИНА ПРИ КАРРАГЕНИНОВОМ ОТЕКЕ ЛАПЫ У КРЫС // Международный студенческий научный вестник. – 2020. – № 1.;
URL: https://eduherald.ru/ru/article/view?id=19877 (дата обращения: 15.09.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
ИЗУЧЕНИЕ ФЛОГОТРОПНОЙ АКТИВНОСТИ МАЗЕЙ
Н-ГЕКСАДЕЦИЛТРИФЕНИЛФОСФОНИЯ БРОМИДА
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Конг Х..
1
Зиганшина Л.Е.
1
Галкина И.В.
1
Орлова О.В.
2
Егорова С.Н.
2
1 ФГАОУ ВПО «Казанский (Приволжский) федеральный университет»
2 ГБОУ ВПО «Казанский государственный медицинский университет»
Четвертичная соль фосфония – н-гексадецилтрифенилфосфония бромид – обладает антибактериальным и противогрибковым свойствами в отношении Staphylococcus aureus, Pseudomonas aeruginosa, Escherichia coli, Proteus mirabilis и Candida Albicans. Установлено, что мази н-гексадецилтрифенилфосфония бромида на основе вазелина эффективны в лечении мастита (воспаления молочной железы) у коров при применении в течение 5 дней. С целью изучения флоготропных свойств (про- или противовоспалительных) мазей н-гексадецилтрифенилфосфония бромида в разных концентрациях провели эксперимент на крысах по моделированию воспалительного отека лап каррагенином. Животным наружно накладывали мази на область стоп в течение 13 дней. Для максимально точной оценки интенсивности моделированной каррагенином воспалительной реакции и потенциального флоготропного действия разрабатываемых мазей рассчитывали площадь под кривой «Прирост объема лап – время». Результаты нашего исследования показали отсутствие флоготропных свойств этих мазей в концентрациях 0,05 и 0,25% — про- или противовоспалительных.
каррагениновый отек лап крыс
мази
антимикотическая активность
бактерицидная активность
воспаление
противовоспалительная активность
1. Галкина И.В. Синтез, строение и исследование биологической активности солей фосфония // В сб.: Фармакология и токсикология фосфорорганических соединений и других биологически активных веществ. (Выпуск 4: Материалы Российской конференции, посвященной 75-летию профессора И.А. Студенцовой). – Казань, 2008. – С. 23.
2. Галкина И.В. Взаимодействие солей фосфония с липидными компонентами мембран // Фармация. — 2009. — № 4. – С. 35–38.
3. ГОСТ Р 50258-92 Комбикорма полнорационные для лабораторных животных. Технические условия доступа: https://www.infosait.ru/Pages_gost/28067.htm (дата обращения: 01.11.2013).
4. Европейская конвенция о защите позвоночных животных, используемых для экспериментов или в иных научных целях (ETS N 123) от 18 марта 1986 г. — доступа: https://docs.pravo.ru/document/view/20823584/19912623 (дата обращения: 01.11.2013).
5. Инструкция по медицинскому применению препарата ТРИДЕРМ®. — доступа https://grls.rosminzdrav.ru/InstrImg.aspx?idReg=6409&t=&isOld=1 (дата обращения: 01.11.2013).
6. Миронов А.Н. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. — М.: Гриф и К, 2012. — 944 с.
7. Патент РФ № 2013112041/15, 10.01.2015.
8. Егорова С.Н., Орлова О.В., Галкина И.В., Тудрий Е.В., Сунагатуллин Ф.А., Сороко В.В. Фармацевтическая композиция Уберит для лечения мастита коров на основе н-тетрадецилтрибутилфосфонийбромида // Патент России № 2538684.2015. Бюл. № 1.
9. Amasceno S. R. B. Carvacryl acetate, a derivative of carvacrol, reduces nociceptive and inflammatory response in mice// Life Sciences. – 2014. — Vol. 94, № 1. Р. 58–66.
10. Su S. Evaluation of the anti-inflammatory and analgesic properties of individual and combined extracts from Commiphora myrrha, and Boswellia carterii// Journal of Ethnopharmacology. – 2012. — Vol. 139, № 2. Р. 649–656.
Четвертичная
соль фосфония — н-гексадецилтрифенилфосфоний
бромид [(С6Н5)3Р+С16Н33]Br — относится к III классу токсичности («умеренно опасные»
вещества) и обладает высокой бактерицидной и антимикотической активностью в
отношении Staphylococcus aureus, Pseudomonas aeruginosa, Escherichia coli, Proteus mirabilis и
Candida Albicans
[1], что обусловливает перспективность применения данного биологически
активного соединения как антисептического средства для местного применения. Установлена эффективность 0,05%-ной
мази н-гексадецилтрифенилфосфоний
бромида на основе вазелина для лечения мастита (воспаления молочной железы) у
коров, обеспечивающая выздоровление в течение 5 дней применения, что
сопоставимо с интрацистернальным (внутривымянным) введением антисептических
средств [7].
Цель исследования
Целью
работы явилось изучение потенциальной флоготропной (про- или противовоспалительной)
активности н-гексадецилтрифенилфосфония бромида при наружном применении в
форме мази.
Материалы и методы
Технология
получения мазей
н-гексадецилтрифенилфосфоний
бромида. Мази н-гексадецилтрифенилфосфоний бромида изготавливали на основе
вазелина в концентрациях 0,05% и 0,25% — перемешиванием биологически
активного соединения (без предварительного измельчения) с основой при температуре
40 °С. Н-гексадецилтрифенилфосфоний бромид растворяется в основе, образуя
однородную мазь-раствор.
Исследование
противовоспалительной активности. Эксперименты были проведены на 24
лабораторных беспородных крысах (самцах) массой 320±33 г. Подопытных животных
содержали в условиях вивария (с естественным режимом освещения; при температуре
22–24oC; относительной влажности воздуха
40–50%) с использованием стандартной диеты (ГОСТ Р 50258-92) [3]. Исследования проводили в соответствии с
правилами качественной лабораторной практики (GLP) при проведении доклинических
исследований в РФ, а также правилами и Международными рекомендациями
Европейской конвенции по защите позвоночных животных, используемых при экспериментальных
исследованиях (1986) [4].
Каррагениновый
отек лап крыс
вызывали субплантарным введением (под подошвенный апоневроз) в заднюю правую
лапу крыс 0,1 мл 1%-ного водного геля каррагенина [6], который готовили перед
введением. Выраженность отека оценивали путем измерения объема лапы животных с
помощью плетизмометра 37140 (Ugo Basile, Италия). Измерения производили до
индукции отека (исходный объем), через 1, 2, 3, 4 и 24 ч после подподошвенного
введения каррагенина, а далее 1 раз в день в течение 13 дней. Лапу животных
погружали в камеру плетизмометра до тибиотарзального сустава.
О
противовоспалительной активности исследуемых соединений судили по уменьшению
прироста объема лапы, выраженного в процентах к исходному объему по сравнению с
группой контроля.
Объем
лапы животного до введения каррагенина считали исходным и принимали за 100%.
%
прироста объема лапы = [(объем после введения каррагенина в соответствующий
момент времени – исходный объем) / исходный объем] *100.
Подопытные животные были разделены на 4
группы по 6 крыс, которым наносили мази на лапу 1 раз в сутки в течение 13
дней:
группа 1: контроль – вазелин;
группа 2: препарат сравнения — Тридерм®
(Шеринг-Плау лабо Н.В., мазь) для
наружного применения, содержащая в 1 г: бетаметазон 0,5 мг (в виде бетаметазона
дипропионата 0,64 мг), клотримазол 10 мг, гентамицин 1 мг (1000 МЕ) [5];
группа 3: 0,05%-ная мазь н-гексадецилтрифенилфосфоний
бромида;
группа 4: 0,25%-ная мазь н-гексадецилтрифенилфосфоний
бромида.
Статистическую
обработку результатов проводили с помощью программы Microsoft Office Excel 2010 с вычислением средней арифметической М,
ее стандартного отклонения δ и стандартной ошибки m. Для оценки достоверности различий
выборок, имеющих нормальное распределение, применяли параметрический t-критерий
Стьюдента. За достоверное принимали различие при уровне вероятности 95 % и
более (p ≤ 0,05).
Для
максимально точной оценки интенсивности моделированной каррагенином
воспалительной реакции и потенциального флоготропного действия разрабатываемых
мазей рассчитывали площадь под кривой «Прирост объема лап – время» следующим
образом. Вычисляли
площадь под кривой с помощью стандартного метода численного интегрирования –
метода трапеций, где площадь криволинейной трапеции заменяется площадью
многоугольника, составленного из N трапеций, при этом кривая заменяется
вписанной в нее ломаной. На каждом из частичных отрезков функция
аппроксимируется прямой, проходящей через конечные значения, при этом площадь
трапеции на каждом отрезке определяется по формуле : ![]()
Высота
трапеций составляет небольшую величину, соответствующую отрезку![]() При этом площадь под графиком функции можно
При этом площадь под графиком функции можно
вычислить как сумму площадей составляющих прямоугольных трапеций.
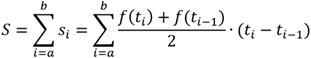
Результаты и обсуждение
Каррагениновый
отек лап крыс
Воспалительная
реакция, вызванная субплантарным введением 1%-ного геля каррагенина,
развивалась в виде отека с увеличением объема лап крыс на 16–24 % от исходного
объема. Максимальное развитие отека наблюдалось у животных контрольной группы
через 3 ч после введения каррагенина, что соответствует литературным данным о
развитии каррагенинового отека лап крыс [8, 9]. Тридерм проявил
противовоспалительную активность на сроке 3 и 4 ч после введения каррагенина с
подавлением отека на 62 % (р = 0,02). На сроке 4 ч после индукции отека
наружное введение мази тридерма способствовало подавлению отека лап крыс на 57
% (р = 0,02). На 3-е, 4-е, 5-е, 6-е и 7-е сутки (через 48, 72, 96, 120 и 144 ч
после введения каррагенина) противовоспалительное действие тридерма проявилось
в виде подавления отека лап крыс на 79, 80, 79, 85 и 95% (р= 0,002; 0,01; 0,01;
0,02 и 0,05) соответственно. На 7-й день эксперимента отек лап крыс под
действием тридерма полностью исчезал.
Мази н-гексадецилтрифенилфосфоний бромида в
концентрации 0,05% и 0,25% не проявили противовоспалительную активность в
условиях эксперимента (таблица 1).
Таблица 1
Процент
прироста объемов лап крыс на различных сроках после моделирования острого
каррагенинового отека на фоне лечения мазью Тридерм, 0,05%-ной и 0,25%-ной мазями н-гексадецилтрифенилфосфоний бромида М±m (δ), Т-тест
Группы | Группа-1 | Группа-2 | Группа-3 | Группа-4 | |||
М±m | Ттест | М±m | Ттест | М±m | Ттест | ||
1 | 16,3±3,5 (8,6) | 9,2±2,3 (5,8) | 0,07 | 12,5±3,7 (9,7) | 0,24 | 9,0±3,0 (6,7) | 0,07 |
2 | 21,3±5,2 (12,7) | 14,0±3,2 (7,8) | 0,14 | 16,0±5,0 (13,4) | 0,25 | 16,9±3,2 (7,1) | 0,24 |
3 | 24,2±5,1 (12,4) | 9,0±2,5 (6,1) | 0,02 | 23,1±6,0 (15,9) | 0,45 | 27,8±1,9 (4,3) | 0,26 |
4 | 22,6±4,9 (12,1) | 9,7±3,2 (7,8) | 0,03 | 25,5±6,0 (15,8) | 0,37 | 33,1±5,5 (12,4) | 0,10 |
24 | 19,6±6,3 (15,3) | 9,2±1,6 (3,9) | 0,08 | 23,8±4,1 (11,0) | 0,30 | 30,1±1,5 (3,4) | 0,08 |
48 | 21,2±4,2 (10,2) | 4,5±1,9 (4,6) | 0,004 | 26,7±2,6 (6,8) | 0,15 | 24,7±4,6 (10,4) | 0,29 |
72 | 15,7±3,9 (9,7) | 3,1±1,2 (3,0) | 0,01 | 20,8±2,7 (7,2) | 0,16 | 19,4±4,5 (10,0) | 0,27 |
96ч | 10,4±2,6 (6,4) | 2,1±1,4 (3,4) | 0,01 | 15,3±1,3 (3,4) | 0,07 | 12,3±3,3 (7,3) | 0,22 |
120ч | 8,0±3,0 (7,5) | 6,8±2,9 (7,6) | 0,39 | 12,4±1,4 (3,1) | 0,15 | ||
144ч | 4,6±2,2 (5,4) | 8,4±2,9 (7,8) | 0,18 | 6,7±2,1 (4,7) | 0,25 | ||
168ч | 4,0±1,9 (4,7) | 4,8±2,4 (6,3) | 0,40 | 2,1±1,9 (4,4) | 0,26 | ||
192ч | 3,1±1,5 (3,7) | 1,7±0,9 (2,4) | 0,23 | 0,8±0,6 (1,4) | 0,10 | ||
264ч | |||||||
—
Т-тест по сравнению с контрольной группой (0,05 г вазелин).
Однако при использовании 0,25%-ной мази н-гексадецилтрифенилфосфоний бромида замечена тенденция к усилению величины
воспалительного отека лап крыс, вызванного субплантарным введением 1%-ного
водного геля каррагенина (рис. 1).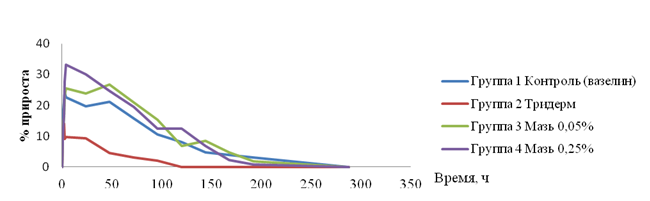
Рис. 1. Процент прироста объема лап крыс, вызванного
субплантарным введением каррагенина, на фоне наружного лечебно-профилактического
введения мази тридерма, мази н-гексадецилтрифенилфосфоний
бромида 0,05% и мази н-гексадецилтрифенилфосфоний бромида 0,25%.
«Провоспалительный»
эффект при увеличении концентрации н-гексадецилтрифенилфосфоний бромида в мази
может быть обусловлен тем, что н-гексадецилтрифенилфосфоний бромид является
амфифильным детергентом, работающим как в водной, так и жировой фазе и
вследствие этого — пенетрирующим агентом, проникающим через биомембраны [2],
что может способствовать глубокому проникновению каррагенина в ткани и тем
самым — усилению воспаления.
При
вычислении площади под кривой «Прирост
объема лап – время» мы не обнаружили различий в показателях контрольной группы
и групп животных, которым использовали мази н-гексадецилтрифенилфосфония бромида, что
позволяет нам делать заключение об отсутствии местно-раздражающих и истинно
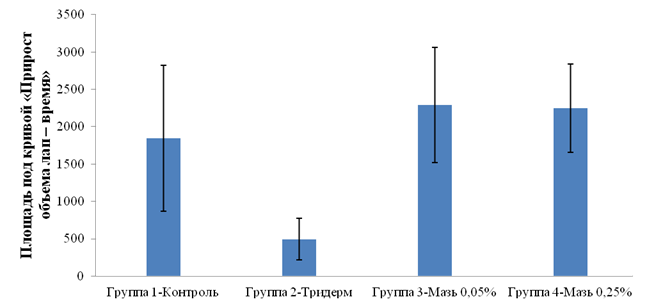
провоспалительных свойств у этого соединения (табл. 2 и рис. 2).
Таблица 2
Площади под кривой «Прирост объема лап – время» при
моделировании отека
у крыс субплантарным введением каррагенина, на фоне наружного лечебного
применения мазей н-гексадецилтрифенилфосфония бромида и тридерма
№ п/п | Группы | Площади |
1 | Контроль | 1845,4±973,6 |
2 | Тридерм | 494,9 ± 277,1 |
3 | Мазь 0,05% | 2293,5 ± 770,7 |
4 | Мазь 0,25% | 2250,3 ± 592,0 |

Рис. 2. Площади под кривой «Прирост объема лап –
время» при моделировании отека у крыс субплантарным
введением каррагенина, на фоне наружного лечебного применения мазей н-гексадецилтрифенилфосфоний
бромида и Тридерм
Выводы
Н-гексадецилтрифенилфосфоний
бромид при наружном лечебном применении в течение 13 дней в форме мази (0,05% и
0,25%) на лапы крыс с моделированным каррагениновым отеком не оказывает
флоготропного (ни противовоспалительного, ни провоспалительного) действия.
Рецензенты:
Зиганшин
А.У., д.м.н., профессор, зав. кафедрой фармакологии фармацевтического факультета КГМУ, г.
Казань;
Альберт
А.Р., д.б.н., профессор, кафедра генетики, института
фундаментальной медициы и биологии, КФУ, г. Казань.
Библиографическая ссылка
Конг Х.., Зиганшина Л.Е., Галкина И.В., Орлова О.В., Егорова С.Н. ИЗУЧЕНИЕ ФЛОГОТРОПНОЙ АКТИВНОСТИ МАЗЕЙ
Н-ГЕКСАДЕЦИЛТРИФЕНИЛФОСФОНИЯ БРОМИДА
// Современные проблемы науки и образования. – 2015. – № 3.;
URL: https://science-education.ru/ru/article/view?id=20121 (дата обращения: 15.09.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
