Геморрагический отек легких свиньи
2. ()2.13.1 , , . . . . , – , . , , , , . , , , , , – . , , , – , . , , . – : – (, ); – (, ), ; – ( ) ; – ( ). . – .
, , , 10- 15 . , , :
– 2- 6- . 20- 30 . , (). , , , .
– . -, . – (, .), . .
-, . . – . – , , , , , , , , , . – , , , , , , . . – . , , . . , , , . – . . . . , , – . . . – . , , . , , – , . 2- 3 , , , – , . , , . , 3- 4 . . , , , . , , . , , . , . , , . . , . , . . – . . , . (Newcastle disease, : , , .) – , , , . (1- 5 ), (), 10- 15 . . – – , . . . , , , (). , , – . , , , , , . . , , , . (. li), , . . . , , , , , . . – ; . – . , , . -. . , . . , , , -, . . . – . , – , , , , . . 75- 80% . , . – , . . . , . , , . . . , . , , . . . . , . , . , . . . , , . , . , . . . . . . , . , , , , . , , , , , , . , . . , , , . . , . – , – . . , , , , , . , , . (Anaemia infectiosa equorum) – . , – – . (, , ). , . . , . – , . , .. , . – ( . remissio – ) – . . , . , . . ( 42), , , , , ( ), , . 1- 3 1 3 , – 20%. 2- 3 , – 7- 30 . . . 237. . . 238. . . , , , .. , . . . . , – «» ( ): – ( ) – . . , . . , , , , . – ( , , , ), . , -. – . , ( ). . 239. . – . ( 5- 6 ), . – , , . . , , , , , . ( ) , () , , . . – . , . , . . – . . , -. , ( ). . , , , – . . , , . , . , . , . , , , . , . -, . ( ), – . . , , . – , . , , – , . – – . – . – , , . – , , , , – – . – . , 10- . , . , , . . , . , , . , 2- 3 , – . . , , . , . . 2- 3- , , – , – . , , . , , , . , . , , , , , . , , , . , . , , . ; . , . . . , , . ( ) – , , . . – – . , . . : – ; – – . , . . 2- – , , , , . – , , , , , , . – , , , , , , , . , . , , – . , , . . . 240. . ( ) , , . – – , , . . . . – , – . , , . , , , . , . . . 241. . , . , . . . . 242. . , , , . () – , , , . . – – . , , . ( ). (). , , – , , . ( ), . . . . , , , , . – , , . , , – . . 243. . . 244. . . 245. . , – – , . , , . , , – , () . – . , – , ( ). , – , , -, . , – . , , . . 246. . . , , , . – (), . . 247. . , , , ( ), , . , , , -. . , ( ). , , , , 10%- ( ). ( .) , ; – ( ) . . ( ) – ( ), ( ) . (Aphtae epixooticae) – , – , () , . Picoriridae. , , , , , : , , , , . . . , , (), . , . , , , , , . . . 248. . . 249. . , – . , , , . , , , . – . , , , . , , . . . . . , . () , . , , . , , , , . – , , , – . , , . , . – ( , ) . , – . – , , . 5- 15 . . 250. . . 251. . , , . . . , , , , . , , – , , , . , , , . , . , . . 252. . . , , , . , . . – , . . 253. . : , , . -, – . . . , . , . 100% . . , . : , , , , , , . . , , . . , (« »). , . , – , . , , . . , , , . , . , – . , , , – , . , , , , . . : , , , , , .. , , , . . , , . , , , , , , . ( – , , ), , , ן, , . – () (). . , (, , ), , (), . . , , . – , () . . – , . . – , – . . . 255. . . – , . , – , , , . , – . , . – , , , , , . .
– , , , , . . – – . – . – . ( ). – . , .
– , . – , , – – . . . – – , , , , , , , . . – , . , , , , , 1 – 2,5 , . . 256. . – – . , , , . , , , , , , , . , . -, . . . – – () – , , , . : , , . – -, , , , -, – . . , , . . 257. . . – , . , . – , , – , , , , . . 258. . . 259. . .
– ( ). III, , , . . – , . ( ) , . . .
– , . . – . , , , , . , . . . ( ), , . , , , , , , , , . , . . , . . , , , . (), , , . , , – . , , , , . . , , – , . , , . ( ), – ( ), . , , . . , – – , , , . – . , , – – ( ), , . – , , . , , , , , . , . , , , . : (-) ( , ). . . , . , , , . – . . . , , , . , , . . , – ( ). , . . . , , . , . , – . , , . . , , – . . . |
Источник
Введение
К нам обратились в ноябре 2014 года по причине внезапной смертности и появления неврологических симптомов у откормочных свиней весом 70 кг. На момент обращения на ферме уже погибли 3 свиней, а также наблюдались признаки атаксии и слабости у других животных в этом же стаде.


Описание фермы и сопутствующих факторов

Животные на ферме в секции откорма
Ферма расположена в районе с низкой плотностью свиней, на юго-западе Бретани. Фермер разводит только поросят-отъёмышей и откормочных свиней, которые поступают из заново формируемого стада с высоким уровнем санитарии. Первые поросята данного происхождения поступили на ферму в июне 2014 года.
Поросята поступают в возрасте 3 недель сразу же после отъёма каждые 7 недель.
Мощность секции доращивания – 400 поросят, а секции откорма – 800 голов.
В настоящее время поросят получают только от молодых свинок и свинок – первоопоросок.
Требования хозяина фермы к уровню внутренней и внешней биобезопасности очень высоки. Перед прибытием рассматриваемой партии молодняка загоны прошли тщательную очистку и дезинфекцию и оставались пустыми в течение 6 недель.
Состояние здоровья стада – источника описано ниже:
- Вирус РРСС: отрицательный
- Актинобациллярная плевропневмония: отрицательный для всех серотипов
- Болезнь Ауески: отрицательный
- Mycoplasma hyopneumoniae: отрицательный
- Вирус свиного гриппа (H1N1, H1N2 и H3N2): отрицательный
- ЦВС-2: вакцинация осуществляется с момента образования стада
В августе 2014 года поросята прошли мониторинг на РРСС и Mycoplasma hyopneumoniae: после 8 недель пребывания поросят на ферме у 10 животных были взяты образцы крови, оказавшиеся серонегативными на оба возбудителя.
С тех пор каких-либо других программ по вакцинации реализовано не было.
Система кормления:
Подача корма поросятам осуществляется при помощи загрузчиков гранулированного материала. Гранулы закупают на комбикормовом заводе.
Откормочные животные получают жидкую смесь в виде супа, распределяемую при помощи системы желобов. Данная смесь готовится из кукурузы и пшеницы, которые выращиваются самим фермером, а дополнительный корм закупается на другом комбикормовом заводе.
Отделения для поросят – отъёмышей оборудованы системой сосковых поилок. Откормочные же животные получают воду только в виде жидкой пищи 3 раза в день.
Клинический отчет (1):
В ноябре 2014 после внезапной гибели 3 свиней было произведено их вскрытие, при этом другие животные из той же партии проявляли признаки атаксии и слабости. Макроскопические поражения, обнаруженные у 3 рассматриваемых животных, приведены в таблице 1.
| Внешние повреждения | Грудная полость | Брюшная полость | |
| Свинья 1 | Никаких, без отклонений в развитии | Сердечная недостаточность | Кровь в тонком кишечнике, застой слизистой, брыжеечные и паховые лимфатические узлы увеличены. |
| Свинья 2 | Фибринозные наложения | Увеличенные брыжеечные и паховые лимфатические узлы, жидкий стул блежно – жёлтого цвета | |
| Свинья 3 | Перикардит, плеврит | Увеличенные брыжеечные и паховые лимфатические узлы, жидкий стул серого цвета |
Таблица 1: Результаты первого вскрытия
Во – первых, макроскопические поражения спровоцировали сепсис, вызванный сальмонеллой. Клинические проявления согласуются с данной гипотезой.
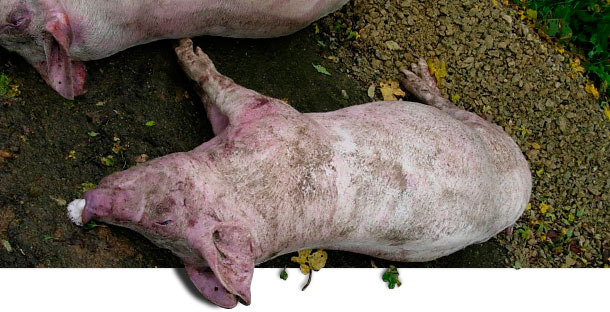
Мёртвые животные на ферме, подвергшиеся вскрытию во время первого посещения фермы.
Пробы, взятые из брыжеечных лимфатических узлов, а также пробы кала толстой кишки каждого животного были отправлены в лабораторию для подтверждения этой гипотезы. Результаты оказались крайне неожиданными.
В каждой из проб:
- В мазках фекалий и лимфатических узлов обнаружена кишечная палочка O139K82;
- Обнаружены факторы вирулентности Stx2e и F18 с помощью ПЦР на культурах кишечной палочки;
- Анализ на Salmonella отрицательный.
Принимая во внимание результаты лабораторных исследований, нами был диагностирован случай вспышки отёчной болезни, что является крайне нетипичным для данного возрастного периода.
Согласно данными антибиограмм, все привычно используемые молекулы были эффективны в отношении этой кишечной палочки.
Клиническая отчет (2): вторая волна клинических проявлений
В результате было решено не кормить всё поголовье животных в течение 24 часов, а затем давать колистин (100 000 МЕ на кг в день в течение 5 дней) вместе с пищей.
Лечение давало положительный эффект в течение последующей недели, но спустя еще 2 недели наблюдалась вторая волна смертности: погибло 8 свиней весом 80 кг, после того как у них проявились признаки менингита, либо без проявления каких-либо симптомов вообще.
Тем не менее, клинические симптомы, по словам хозяина фермы, были все еще умеренными. Во время посещения фермы мы не обнаружили никаких признаков респираторных или пищеварительных расстройств. Но все же животные внешне проявляли различную симптоматику: у некоторых наблюдался некроз ушей, у одной из свиней был дерматит и нефропатия.
Все потери были сконцентрированы на 2 кормушках, в 2 разных комнатах, и у 3 свиней здесь проявлялись признаки атаксии.
I
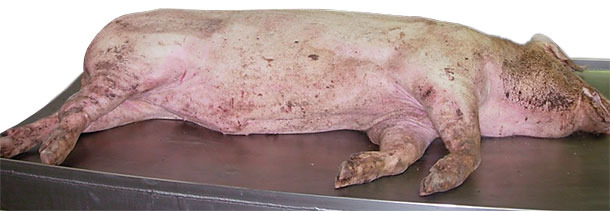
Мертвая свинья: вскрытие и забор проб осуществлены во время второго посещения фермы
Проведено новое вскрытие 80 – килограммовых свиней: макроскопические повреждения сходны с наблюдаемыми 2 неделями ранее.
Хотя при этом у одного из животных был обнаружен отёк лёгких. Кроме того, у каждой свиньи были увеличены лимфатические узлы (как брыжеечные, так и паховые).
На анализ направили новые образцы, получены те же результаты: кишечная палочка O139K82 обладала факторами патогенности Stx2e и F18. Антибиограмма показала аналогичную чувствительность к антибиотикам.
Таким образом, мы имели дело со второй волной заболевания. Это тем более удивительно, потому как обычно и голодание, и применение колистина эффективны в борьбе с данной патологией.
Клинический отчет (3): поиск факторов, спровоцировавших вспышку заболевания
Принимая во внимание единичность данного случая, мы приступили к поиску факторов, которые могли спровоцировать заболевание в столь позднем возрасте:
- Возбудители коинфекций, в особенности те, которые обладают иммуносупрессивными свойствами;
- Вентиляция
- Санитарное состояние воды
- Изменения в питании
1. Возбудители коинфекций
На основании повреждений, наблюдаемых во второй раз и сопутствующих клинических признаков (их разнородность, некроз ушей, дерматит и нефрит), мы заподозрили ЦВС – 2.
Незамедлительно последовали анализы ПЦР:
- Лимфатических узлов трупов недавно погибших свиней
- Сывороток крови от 15 свиней из данной партии, объединенных в пулы по 5.
Из – за отсутствия формалина во время проведения аутопсии не удалось сохранить ни один из образцов для гистологического исследования. Все результаты оказались отрицательными.
Анализов на РРСС, вирус свиного гриппа, актинобациллезную плевропневмонию и Mycoplasma hyopneumoniae не проводилось, потому как каких-либо клинических признаков со стороны этих патогенов с момента вспышки заболевания или в более ранние сроки не наблюдалось.
2. Вентиляция
Хозяин фермы не был согласен с этим пунктом, утверждая, что никаких изменений в оборудовании или самой системе вентиляции он не проводил. Однако случаи каннибализма наблюдались и ранее, среди свиней другого происхождения наряду с эпизодическими признаками недостаточной вентиляции (например, уровень аммиака).
3. Санитарное состояние воды
После второй вспышки эдемы был проведен бактериологический анализ воды. Проба была забрана из конечной части системы водоснабжения, из крана, прошедшего дезинфекцию незадолго до этого. Результаты представлены в таблице 2.
| Параметры | Пробы | Норма* |
| Общие колиформные бактерии | 0 г/мл | |
| Фекальные колиформы (E coli) | 0 г/мл | |
| Стрептококк фекальный | 0 г/мл | |
| Сульфатредуцирующие анаэробы | 0 г/мл | |
| Общее бактериальное число (22°C) | 0 /мл | < 100 |
| Общее бактериальное число (37°C) | 0 /мл | < 10 |
*Нормы для употребления человеком
Следовательно, подтвердилось, что вода, потребляемая животными, была пригодной для питья.
4. Изменения в питании
Рацион животных состоит из:
- 50% кукурузы
- 20% пшеницы
- 30% прикорма, закупаемого у комбикормового завода
Прежде всего, был проведен анализ кукурузы на наличие микотоксинов. Из соображений экономии анализ проводился только на наличие ДОН (дезоксиниваленола) (метод ИФА): обнаружено 196 ppb. В таблице 3 приведены параметры анализа кукурузы.
| Сырой продукт | Сухой продукт | |
| Влажность | 37.4 % | |
| Сухое вещество | 62.6 % | |
| Общее количество азотистого вещества | 5.2 % | 8.3 % |
| Крахмал | 44.7 % | 71.5 % |
До этого момента фермер добавлял в корм соль. Животных кормили 3 раза в день жидкой смесью, состоящей из 2,7 кг разжиженного корма и 2,8 л воды на одно животное. Это означает, что каждый свинья получала 7,6 л воды каждый день, что может выходить за пределы нормы для свиней весом более 80 кг (норма – потребление воды объёмом 10% от живой массы [Massabie P, 2001], см. таблицу 4), в особенности при сопутствующем повышенном потреблении NaCl.
| Возраст | Вес | Потребление | Объём потребляемой воды |
| 70 д | 30 кг | 1.5 кг | 4.23 л |
| 90 д | 42 кг | 2 кг | 5.64 л |
| 110 д | 55 кг | 2.55 кг | 7.19 л |
| 130 д | 75 кг | 2.6 кг | 7.33 л |
| 150 д | 80 кг | 2.65 кг | 7.47 л |
| 170 д | 100 кг | 2.7 кг | 7.61 л |
После второй вспышки отёчной болезни хозяином фермы было принято решение увеличить потребление подкислителя (5кг/т корма), и нам удалось остановить потребление NaCl.
C этого момента ситуация значительно улучшилась несмотря на снижение роста в данном поголовье животных. Ни потерь, ни симптомов расстройства нервной системы больше не наблюдалось. Кроме того такие признаки и явления не были отмечены и у последующего поголовья.
Обсуждение полученных результатов
Отёчная болезнь – патология, довольно распространенная на французских фермах. В большинстве случаев клинические симптомы и смертельный исход наблюдаются среди поросят-отъёмышей спустя несколько недель после отъёма [Moxley РА, 2000], а иногда и у откормочных поросят [Fairbrothers JM и др]. Однако на французских фермах не было зарегистрировано ни одного случая отёчной болезни у свиней весом свыше 70 – 80 кг, и ни одного подтверждения не было найдено также и в международной литературе.
Так как в одно и то же время проводилось множество изменений (увеличение потребления подкислителя, снижение потребления соли), то было просто невозможно четко определить факторы, которые спровоцировали вспышку заболевания. Но при этом мы практически уверены, что именно ограничение потребления воды в совокупности с высоким потреблением соли является причиной вспышки данного заболевания.
Более того, вопросы, связанные с вентиляцией, не были исследованы и учтены, при этом нарушение движения воздушных потоков все-таки имеет место быть.
Источник
Гречухин А.Н. ООО”Кронвет”
Цирковирусная болезнь свиней – инфекционная болезнь свиней, главным образом поросят-отъемышей, вызываемая цирковирусом и характеризующаяся отставанием в росте и развитии, поражением кожи, развитием респираторного синдрома.
Возбудитель вирус семейства Circoviridae. Существует непатогенный цирковирус свиней (ЦВС-1) и патогенный (ЦВС тип 2), который размножается в клетках лимфоидной ткани. Чрезвычайно устойчив во внешней среде. Размножается в клетках иммунной системы. В организме концентрируется в селезенке, лимфатических узлах, альвеолярных макрофагах. В последнее время определено 2 подтипа ЦВС2а и ЦВС2б, которые по своим антигенным и другим свойствам практически не отличаются.
Один из самых устойчивых к дезинфектантам вирусов. Фумигация формальдегидом в течение 24 часов не инактивирует вирус. Обработка йодом уничтожает возбудитель только в 10% концентрации с экспозицией 2 часа. Глутаровый альдегид инактивирует вирус в 1% концентрации в течении 20 минут. Выдерживает обработку 5 % фенолом в течение 2 часов при температуре 37º С. Нагревание до 80º С в течение 15 минут не убивает вирус, необходимо кипятить материал не менее 10 минут. Замораживание консервирует.
Болезнь распространена повсеместно. Источником возбудителя инфекции служат свиньи всех половозрастных групп, выделяющих вирус со всеми секретами и экскретами. Однако одного наличия вируса недостаточно для возникновения инфекции. Является типично факторной инфекционной болезнью и наносит свиноводческим хозяйствам наиболее ощутимый экономический ущерб. Эпизоотическая ситуация в России, как впрочем и в Европе, такова, что практически нет стад свиней свободных от цирковируса второго типа. Но в одних хозяйствах болезнь не проявляется или проявляется в единичных случаях, а в других уносит до 50% поросят на доращивании.
Наиболее восприимчивы поросята-отъемыши. Особенно подвергнувшиеся стрессу в виде перегруппировок, вакцинаций т.д.
Способствуют проявлению цирковирусной инфекции следующие основные факторы:
-моноблочная застройка
– чрезмерная концентрация и переуплотнение животных
-наличие микотоксинов в кормах
– трехфазная система выращивания
– осеменение свинок с откорма
– увлечение вакцинациями и иньекционными обработками поросят до 60 дневного возраста
Основными клиническими признаками болезни являются отставание в росте и развитии. Поросята через 2-3 недели после отъема начинают плохо поедать корм, сбиваться в кучи, кожный покров сереет ( Рис 1 ).
Поросята больные ЦВИС
Рисунок 1
На коже появляется мелкая сыпь, которая может сливаться в области живота, промежности ( Рис.2).
Геморрагии на коже
Рисунок 2
Развивается респираторный синдром. Подобная картина наблюдается: в хозяйствах моноблоках, хозяйствах не имеющих племенных ферм, на предприятиях имеющих не отрегулированные системы жизнеобеспечения, а также на фоне микотоксикозов, особенно смешанного типа.
На свиноводческих комплексах с высокой степенью биозащиты, вновь построенных, с отрегулированными системами микроклимата, имеющих животных высокой генетики болезнь проявляется несколько иначе. У отдельных поросят наблюдается конъюктивит, массово некроз кончиков ушей ( Рис.3).
Конъюктивит и некроз кончиков ушей
Рисунок 3
Причем диагноз ставится как каннибализм. И только у отдельных поросят, причем в более старшем возрасте (60-70 дней) может развиваться дермальный некротический васкулит. Отход в подобных хозяйствах на доращивании не превышает 8-15% вместе с санитарным браком.
Паталогоанатомические изменения. Трупы истощены, анемичны, желтоватого или грязно-серого окрашивания, на коже могут быть сыпь и струпья. ( Рис.4).
Геморрагический некротический васкулит
Рисунок 4
Сыпь образуется вследствие воспаления стенок кровеносных сосудов, что ведет к дермальному некротическому васкулиту. При детальном и внимательном рассмотрении отдельных пятен видна точка некроза в центре них.
При вскрытии отмечается поражение лимфоидной ткани: впервые при возникновении в хозяйстве, особенно на импортном, чистом поголовье лимфоузлы увеличены повсеместно, сочные серо-желтого цвета (Рис 5 ).
Множественный лимфоденит при ЦВИС
Рисунок 5
Напоминают цветом и консистенцией лимфоузлы у больных лейкозом коров. В дальнейшем, по мере развития эпизоотического и инфекционного процесса приобретают мраморное окрашивание (Рис. 6). Особенно характерно увеличение паховых лимфатических узлов (Рис.7). В некоторых случаях они имеют вид гематомы (Рис. 8).
Увеличение лимфатических узлов брыжейки
Рисунок 6
Увеличение паховых лимфатических узлов и их гиперемия
Рисунок 7
Отек легких, геморрагические лимфатические узлы
Рисунок 8
Легкие в начальной стадии болезни отечны затем появляются участки с более плотной консистенцией, с очагами воспаления, далее характер которого определяет секундарная микрофлора.
Изменения селезенки очень различные. Селезенка обычно увеличена, в отдельных случаях значительно, имеет вид “септической ” селезенки, нередко отечна и воспалена ( Рис. 9)
Воспаление селезенки при ЦВИС
Рисунок 9
Даже могут быть краевые очаги некроза как при классической чуме свиней ( Рис. 10), или в виде мельчайших участков в виде отдельных сосочков.
Краевые очаги некроза на селезенке
Рисунок 10
Почки могут быть увеличены, с кровоизлияниями и даже с геморрагическими инфарктами. Подобные изменения больше характерны для классической чумы свиней и даже для африканской чумы, что крайне важно помнить при осуществлении дифференциальной диагностики. За цирковирусной инфекцией легко пропустить эти особо опасные инфекционные болезни.
Диагноз ставят на основании эпизоотологических данных, клинической картины болезни, патоморфологического метода. При совокупности этих методов и при снижении экономических показателей можем говорить о наличии цирковирусной инфекции. По Европейским критериям наличие поросят с дермо-некротическим васкулитом и увеличением лимфатических узлов у павших поросят достаточно чтобы говорить о присутствии болезни и обосновании иммунизации, даже без увеличения технологического падежа. Выделение цирковируса 2-го типа без клиники и патанатомии не является диагностическим показателем.
Подтверждается диагноз путем постановки ПЦР с выделением цирковируса 2-го типа из измененных органов или тканей. На территории Европейского Союза безоговорочными критериями подтверждающими ЦВИ-2 являются исследования поврежденных органов методами иммуногистохимии и цитологической гибритизации. В нашей стране эти методы не осуществляются из-за отсутствия соответствующего оборудования. Количественная ПЦР проводится во ВНИИЗЖ.
Проблемы с диагностикой часто возникают из-за секундарных инфекций ( гемофилезный полисерозит, пастереллез ). При вскрытии находим изменения свойственные этим болезням, лаборатория выделяет возбудитель. Однако всегда надо обращать внимание опять на увеличение всех лимфоузлов и особенно паховых, которые никогда не увеличены ни при полисерозите, ни при пастереллезе.
Мероприятия. Самыми эффективными методами профилактики данной болезни является выработка технологии позволяющей как можно меньше воздействовать на поросят всевозможными стрессовыми факторами, а именно:
– перевод на двухфазную систему выращивания
– строжайший контроль за наличием микотоксинов в кормах
– без острой необходимости не вакцинировать поросят в предотъемный
и послеотъемный период, особенно живыми вакцинами
– с осторожностью относиться к методу гипериммунизации против КЧС.
В России для профилактики цирковироза принято использовать тканевую инактивированную вакцину, изготовленную из “местного” материала. Учитывая высокую устойчивость цирковируса к инактивации, необходимо строжайше контролировать технологический процесс, во избежание перезаражения стада цирковирусом из-за недостаточно инактивированного препарата.
Не секрет, что на сегодняшний день многие свинокопмлексы используют подобные “тканевые” вакцины. Материалом для изготовления служат пораженные легкие, мезентериальные лимфоузлы и иммунокомпетентные органы. При ознакомлении с технологией изготовления подобных вакцин, часто обращает на себя внимание отсутствие в условиях производственных лабораторий комплексов технологических регламентов и главное отсутствие опыта работы. Что, как уже говорилось выше, может привести к необратимым последствиям.
С апреля 2009 года в России зарегестрироанна и сертифицирована инактивированная, субъединичная вакцина PorcilisPCV(Порцилис ПСВ) для специфической профилактики и контроля свиного цирковируса 2 типа.
Вакцина может быть применена по однократной или двукратной схеме вакцинации.
Однократную схему вакцинации рекомендуется использовать с 21 по 35 дни жизни в хозяйствах, где клинические признаки цирковирусной инфекции проявляются после 60 дневного возраста. Очень важно при однократной вакцинации знать титр колостральных антител, определяющих уровень материнского иммунитета в день вакцинации, так как колостральные иммуноглобулины нейтрализуют вакцинный антиген, однако вакцина Порцилис ПСВ вызывает напряженный, продолжительный иммунный ответ даже при уровне колострального иммунитета 5.5log2.
Двукратная схема вакцинации рекомендуется для хозяйств где цирковирусная инфекция протекает остро, начиная с 50 дневного возраста совместно с вирусом РРСС и этот симбиоз вызывает развитие респираторного симптомокомплекса, который протекает со значительным выбытием поросят. В этом случае первое введение вакцины целесообразно делать поросятам на 15 день, второе на 35 день жизни.
Окончательная схема вакцинации разрабатывается индивидуально после клинического и паталогоанатомического обследования поголовья , а также исследование сывороток крови на уровень колостральных антител к цирковирусу 2-го типа.
Необходимо понять три основных момента от которых зависит успех вакцинации :
– в каком возрасте происходит массовое инфицирование полевым штаммом цирковируса 2-го типа
– в каком возрасте наблюдается клиническая картина болезни с типичным для цирковируса 2-го типа (мультисистемное истощение, дермонефротический синдром)
– какая напряженность материнского иммунитета в момент однократной вакцинации вакциной Порцилис ПСВ
Следует помнить, что любая вакцина против ЦВИС не является панацеей, а может быть лишь высокотехнологичным инструментом во всем комплексе мероприятий.
По мере осуществления вакцинации заболеваемость будет снижаться, медикаментозными обработками секундарные инфекции нужно выдавливать в более поздние сроки, когда поросята болеют легче и переносят инфекционный процесс лучше, без серьезных экономических потерь.
Т
аким образом, при умелом сочетании иммунопрофилактики, применения медикаментозных средств и совершенствовании технологии можно добиться успеха в снижения до минимума потерь от цирковирусной инфекции свиней.
Источник
