После облучения головного мозга отек мозга
Осложнения лучевой терапии головы, шеи и ее побочные эффекты
Все побочные эффекты лучевой терапии можно подразделить на острые и хронические. Их возникновение зависит от общей дозы облучения, однократной дозы облучения, предыдущего или сопутствующего лечения (хирургического вмешательства и/или химиотерапии), объема опухоли.
Одним из главных факторов, ограничивающих дозу лучевой терапии, является мукозит. Выраженный лучевой мукозит может стать причиной перерывов в лечении с последующим рецидивом опухолевого роста. Если иммунная система больного подорвана химиотерапией, слизистые оболочки могут инфицироваться. Наиболее распространенным хроническим побочным эффектом является ксеростомия.
С целью повышения вероятности успеха лучевой терапии пациент должен отказаться от курения (курение повышает сопротивляемость опухолевых клеток облучению), тщательно следовать схеме лечения, избегая перерывов более чем на пять дней, активно искать поддерживающей терапии. Перед началом лечения пациента должен обследовать фониатр/специалист по глотанию, диетолог, специалист по контролю боли и психолог.
Все они могут помочь пациенту справиться с острыми и хроническими побочными эффектами лучевой терапии. Также перед началом лучевой терапии пациента должен осмотреть стоматолог, необходимо выполнить ортопантомограмму, при необходимости удалить больные зубы, приобрести фторированные каппы для зубов, которые могут быть полезны у больных с пломбами (наличие пломб ведет к более выраженному мукозиту, т. к. ионизирующее облучение рассеивается при встрече с пломбировочным материалом).
а) Острые побочные эффекты лучевой терапии головы и шеи. Побочные эффекты обычно появляются на третьей неделе лечения. Развивается дерматит, снижается секреция слизи, появляются охриплость, боли в горле, дисфагия, утомляемость, нарушения вкуса, ксеростомия. В редких случаях на первой неделе может развиваться паротит (вследствие закупорки выводных протоков железы густой слизью).
Ближе ко второй половине курса, когда симптомы усиливаются, у пациентов появляется необходимость в использовании кремов и масел для кожи, муколитиков, наркотических анальгетиков, противорвотных препаратов, изменений в диете (переход на жидкую пищу и жидкие питательные смеси). Пациентам, которые не способны перенести весь курс лечения (особенно в сочетании с химиотерапией), может быть наложена гастростома.
Пациенты могут сильно терять в весе, у них нарушается заживление ран. Все это ведет к сложностям с завершением курса лечения. Важно минимизировать любые перерывы в лечении, поскольку подавление роста опухоли нарушается при прерывании лечения на пять дней и более.
б) Хронические побочные эффекты лучевой терапии головы и шеи. Полное восстановление после курса лучевой терапии занимает несколько недель или месяцев. Отказаться от приема дополнительных препаратов пациенты обычно могут спустя 4-6 недель после окончания лечения. Наиболее тяжелыми хроническими побочными эффектами являются фиброз мягких тканей шеи и жевательной мускулатуры, выпадение волос, хондронекроз, дисфагия, гипотиреоз, ксеростомия.
Избежать образования стриктур верхнего сфинктера пищевода и фиброза мышц, участвующих в глотании, можно при раннем начале специальных глотательных упражнений. Невозможность нормального глотания может вести к хронической аспирации и необходимости постоянного использования назогастрального зонда. Для предотвращения распада зубов и остеорадионекроза пациенты должны тщательно соблюдать гигиену полости рта, избегать удаления или имплантации зубов.
в) Направление будущих исследований. В рандомизированном исследовании RTOG-H5022 будет оценена эффективность добавления С225 к курсу химиолучевой терапии (ускоренный курс облучения с двумя курсами цисплатина).
С учетом того, что у пациентов с раком ротоглотки, ассоциированным с ВПЧ, удается достичь превосходных результатов при использовании традиционных методов лечения, многие лечебные учреждения и исследовательские группы занимаются поиском наименее агрессивного варианта. Аналогичных результатов можно достичь использованием меньших доз облучения и меньшим количеством курсов химиотерапии, снизив при этом общую токсичность.
У пациентов с крайне агрессивными опухолями, которым требуется более радикальное лечение, возможно применение нескольких подходов: использование индукционной химиотерапии, эскалация дозы облучения, подключение брахитерапии или биологической терапии.
С другой стороны, ведется поиск радиопротективных препаратов, которые помогут предотвратить развитие мукозита и других побочных эффектов и одновременно с этим увеличить вероятность сохранения функции пораженного органа, поскольку целью лечения является не только подавление опухолевого роста, но и поддержание общего качества жизни на достойном уровне.
Например, исследуется возможность использования лучевой терапии с модулированной интенсивностью (ЛТМИ) для снижения риска развития дисфагии и снижения дозы химиолучевой терапии. Это позволит сохранить пациентам глотание и устранит необходимость в использовании назогастрального зонда.
С целью дальнейшей персонализации лечения разрабатываются новые методы лучевой диагностики и молекулярной диагностики, с помощью которых, как мы надеемся, удастся найти сбалансированный способ излечения с использованием минимально допустимых доз и косметическими и функциональными результатами лечения.
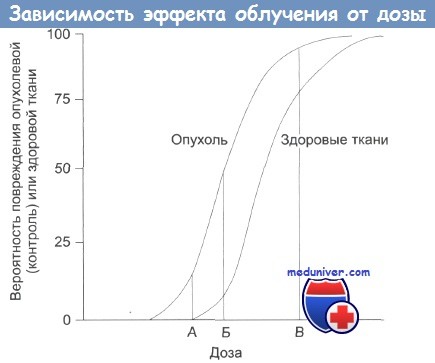 Зависимость терапевтического эффекта от дозы облучения.
Зависимость терапевтического эффекта от дозы облучения.
А — нижняя безопасная доза;
Б — увеличение дозы: растет поражение здоровых тканей;
В — наивысшая вероятность успешного лечения, но и высокая вероятность поражения здоровых тканей, многочисленные побочные эффекты, некоторые из которых могут проявиться в отдаленном будущем
г) Ключевые моменты лучевой терапии:
• В основе лучевой терапии лежит нарушение способности опухолевых клеток к делению. Ионизирующее излучение вызывает формирование свободных радикалов, которые разрывают двухспиральную цепь ДНК.
• Здоровые ткани обладают большей репаративной активностью, чем опухолевые, поэтому они более устойчивы к действию ионизирующего излучения. Именно эта разница в репаративных свойствах нормальных и опухолевых тканей и позволяет убивать злокачественные клетки, сохраняя целостность и функциональность окружающих тканей.
• Как правило, для избирательной терапии используется доза в 50 Гр (грэй), для лечения остаточных микроскопических опухолей — 60 Гр, для лечения крупных новообразований — 70 Гр.
• В случае плоскоклеточного рака головы и шеи время и частота использования лучевых методов лечения имеют особое значение, т.к. данные опухоли способны к отложенной ускоренной репопуляции на фоне проводимой лучевой терапии. Феномен репопуляции во время терапии и способность раковых клеток к дифференциальной репарации часто обусловливает необходимость использования различных фракционных режимов подачи ионизирующего излучения.
Улучшить результаты лечения можно сокращением общего курса терапии и эскалацией дозы с гиперфракционированием.
– Также рекомендуем “Особенности анатомии полости рта”
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Оглавление темы “Болезни полости рта и глотки”:
- Методы лучевой терапии при раке гортани
- Осложнения лучевой терапии головы, шеи и ее побочные эффекты
- Особенности анатомии полости рта
- Причины и патогенез рака полости рта
- Стадии рака полости рта и классификация по TNM
- Жалобы при раке полости рта и его диагностика
- Методы лечения рака полости рта и его осложнения
- Признаки доброкачественного образования полости рта
- Особенности анатомии глотки и пищевода
- Бактерии как причина боли в горле – фарингита
Источник
Схема лучевой терапии опухоли головного мозга – Европейские рекомендации
Лучевая терапия — лечение заболеваний с использованием ионизирующего излучения. Как правило, применяется при злокачественных заболеваниях, а также при некоторых доброкачественных (например, при макроаденомах гипофиза). В большинстве случаев лучевая терапия опухолей головного мозга проводится в послеоперационном периоде, методом внешнего облучения рентгеновскими лучами. Также используется ряд других методов, таких как интаоперационная лучевая терапия, корпускулярная и брахитерапия. Значение лучевой терапии во многом зависит от радиочувствительности опухоли.
Возможно лечение (например, при медуллобластомах, герминоклеточных опухолях) или продление жизни (например, при глиомах). Цель заключается в обеспечении максимальной или лечебной дозы для опухоли и минимизации повреждения нормальной ткани.
а) Механизм действия. Лучевая терапия проводится избирательно путем концентрации высокой дозы излучения в области опухоли, при этом учитываются различия в резистентности нормальных и раковых тканей. Облучение повреждает ДНК, которая в свою очередь может восстановиться или привести к гибели клеток с помощью различных механизмов. Осознанное управление молекулярными последствиями облучения приводят к ощутимому улучшению результатов.
Чтобы воспользоваться разницей в восстановлении и кинетическом росте в ответ на облучение, суммарная доза делится на малые дозы или «фракции». В принципе при большем количестве фракций можно достигнуть большего эффекта. Таким образом, радикальное лечение сводится к 30 или более фракциям, в то время как паллиативное лечение включает значительно меньше.
б) Стандартное базовое оснащение. Облучение центральной нервной системы (ЦНС) должно выполняться на линейном ускорителе с энергией 4-6 MV. Он должен иметь возможность для структурирования луча и модуляции интенсивности лучевой терапии (МИЛТ). Должны быть доступны современные средства планирования лучевой терапии, основанные на КТ с модулем имитации и проверки луча.
В основном лучевая терапия проводится в размере одной фракции в 1,8-2,0 Гр в день, пять дней в неделю. Для быстро растущих опухолей большее теоретическое преимущество дает ускоренная терапия (больше, чем одна фракция в день). Кроме того, лучевая нагрузка в низких дозах позволяет дать более высокую суммарную дозу с меньшим воздействием на неизмененные ткани (гиперфракционированая лучевая терапия) с лучшим воздействием на опухоль. Это может быть эффективно при некоторых опухолях у детей. У взрослых не было выявлено преимуществ ни ускоренного, ни гиперфракционированого облучения.
в) Новейшие разработки:
1. Конформная лучевая терапия. Конформная лучевая терапия подразумевает формирование пучка по размеру и контуру опухоли. Это достигается с помощью (микро) многолепесткового коллиматора или блоков литого свинца.
2. Модуляции интенсивности лучевой терапии. Обычно интенсивность дозы облучения по ходу пучка одинакова. При использовании нескольких пучков с неоднородными (с модуляцией интенсивности) профилями можно сформировать единую дозу в очень сложной (даже вогнутой) области. Это имеет свои преимущества при работе рядом с чувствительными или жизненно важными структурами или когда желательно неоднородное распределение дозы.
3. Стереотаксическая радиохирургия/лучевая терапия. Стереотаксис в лучевой терапии означает лечение поражений, локализованных по отношению к внешней системе координат. При адекватной фиксации пациента стереотаксическое излучение может быть доставлено с точностью менее чем 1 мм. Используя эту методику, можно вывести жизненно важные структуры из пучка. Стереотаксическая радиохирургия (СРХ) подразумевает однократное применение абляционной дозы радиации.
4. Чувствительность к облучению. Было опробовано множество веществ, которые теоретически должны повышать чувствительность опухолевой ткани к излучению. К ним относятся сенсибилизаторы, действующие на субклеточном уровне, такие как IUdR и мизонидазол. Ни один из них не оказался эффективным.
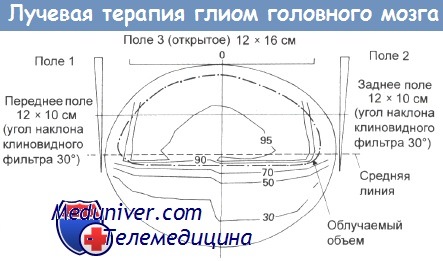
 Облучение глиомы коры мозга внешним пучком.
Облучение глиомы коры мозга внешним пучком.
Трехпольное облучение всего полушария мозга. Облучаемый объем показан пунктирной линией.
г) Стандартные подходы к лучевой терапии:
1. Глиомы высокой степени злокачественности. Лучевая терапия увеличивает выживаемость пациентов с недавно диагностированной глиомой высокой степени злокачественности (ГВСЗ). Для оптимизации лечения таких больных учитываются такие прогностические факторы, как возраст, общее состояние, точное гистологическое заключение и, в меньшей степени, размер опухоли и резектабельность. Пациенты с большими шансами на эффективность терапии должны проходить максимальное облучение, в то время как при плохом прогнозе можно дать короткий курс лучевой терапии или вообще его не проводить.
Лечение должно быть проведено сразу же после операции. Высокие дозы излучения локализуют в области резекции с добавлением около 2 см от ее края. Облучение большого объема мозга без необходимости больше не считается необходимой. Резекция опухоли может улучшить устойчивость к радиации и снизить потребность в стероидах, которые часто приходится назначать при лучевой терапии.
Максимальное стандартное лечение составляет 56-66 Гр в течение 5-7 недель. Нет подтверждения, что увеличение интенсивности лечения с помощью интерстициальной лучевой терапии, стереотаксической радиохирургии или с помощью альтернативных схем фракционирования улучшает результаты.
Пациентам с неблагоприятным прогнозом может быть предложен короткий курс облучения (например, 30 Гр за шесть фракций).
Было установлено, что прием темозоломида во время и после лучевой терапии улучшает выживаемость у пациентов с глиобластомой. В этом исследовании двухлетняя выживаемость увеличилась с 10 до 26% с улучшением «времени до прогрессирования» без ущерба для качества жизни. У пациентов с хорошим статусом, перенесших удаление опухоли, лучевая терапия наиболее эффективна. Этот сопутствующий/адъювантный режим сейчас принят в качестве стандарта лечения пациентов с глиобластомой во многих странах.
2. Астроцитомы низкой степени злокачественности. По общему опыту, лечение может вызвать регресс глиом низкой степени злокачественности и улучшить клиническое состояние. Тем не менее, ее роль менее ясна, чем при ГВСЗ. По данным крупномасштабного исследования EORTC и RTOG было установлено, что лучевая терапия не улучшает выживание, но увеличивает время до прогрессирования опухоли. Средняя доза (45 Гр) является столь же эффективной, как и более высокие дозы (60 Гр). Кроме того, выяснилось, что факторы риска являются прогностическими для пациентов, способных выиграть от такого лечения.
Пациенты с хорошим прогностическим показателем (удовлетворительное состояние, возраст < 50, размер опухоли < 6 см, опухоли не связанные со средней линией) после первоначального диагноза могут находиться под наблюдением. Когда планируется лучевая терапия, зона облучения должна включать в себя всю область опухоли, плюс 1-2 см по краю. Общая доза облучения должна быть не более 54 Гр (обычно 50 Гр), не более 1,8 Гр за фракцию.
3. Опухоли, обладающие большим потенциалом метастатазирования. Некоторые опухоли распространяются с током спинномозговой жидкости (например, ПНЭО, некоторые герминоклеточные опухоли). Для них может быть необходимо облучение и спинного мозга. Дозы облучения должны быть равномерно распределены по всей поверхности оболочек и их содержимого с увеличением дозы в областях первичной опухоли и скопления метастазов.
Планирование должно осуществляться с помощью КТ и настроено на максимальную протекцию, чтобы снизить риск повреждения жизненно важных структур и отдаленных осложнений. Обычно проводится параллельное облучение полей мозга и нижней части позвоночника с совмещением одиночного заднего поля позвоночника. Стандартное лечение медуллобластомы без химиотерапии включает облучение всего спинного и головного мозга в дозе 30-35 Гр и опухоли в дозе 55 Гр. Доза может быть снижена при сочетании с химиотерапией. Совершенствование лечения является задачей современных исследований.
4. Радиотерапия доброкачественных опухолей. Некоторые доброкачественные опухоли чувствительны к лучевой терапии (менингиома, аденома гипофиза, краниофарингиома). Долгосрочные перспективы выживания хороши, поэтому, при наведении и дозировке необходима особая точность, для чего в соответствующих случаях может использоваться стереотаксическое наведение IMRT и некомпланарное планирование. Минимальная эффективная фракционная доза составляет не менее 2 Гр. В некоторых случаях может быть использована СРХ.
5. Метастазы. Лучевая терапия является одним из основных методов в лечении метастазов головного мозга, но, возможно, ею отчасти злоупотребляют. Отбор пациентов должн быть основан на принятой схеме классификации. У пациентов с множественными метастазами и тяжелым соматическим статусом, вероятно, преимуществ от лечения не достигается. Молодые пациенты с лучшим состоянием должны получать короткие курсы облучения (20 Гр за пять фракций в течение одной недели).
Пациенты с солитарными (или несколькими) метастазами в головном мозгу, особенно если контролируется системное заболевание, оцениваются в отношении возможности радикального лечение. Хирургия и стереотаксическая радиохирургия (СРХ) в этом случае имеют схожую эффективность. Облучение всего головного мозга снижает риск рецидива и является полезным дополнением.
д) Отдаленные последствия лучевой терапии. Здоровая ткань мозга, прилегающая к опухоли, неизбежно подвергается риску повреждения. Наиболее важные изменения происходят достаточно поздно после облучения (от 6 месяцев до 10 лет) и включают изменения белого вещества, повреждение сосудов, нейронов, глиоз и кальцификации. Клинические проявления могут варьировать от незначительного ухудшения когнитивных функций до грубого неврологического дефицита. Риск после тщательно взвешенного и дозированного облучения, очевидно, преувеличивается.
У пациентов с глиомами низкой степени злокачественности отдаленные последствия могут быть умеренными по сравнению со случаями дефицита перед облучением. У пациентов с предшетвующими нарушениями когнитивных функций после лучевой терапии может наблюдаться их улучшение.
е) Клинические и научные разработки лучевой терапии опухоли головного мозга:
1. Протоны. В протонном пучке наибольшее количество энергии выделяется на последних нескольких миллиметрах пути, известном как «максимум Брэгга». Это свойство можно использовать для доставки в опухоли больших доз облучения, в том числе находящихся в непосредственной близости от жизненно важных структур. Наиболее распространенной областью применения в ЦНС являются хордомы ската черепа и другие опухоли основания черепа. Однако данная технология очень дорога и доступна в очень немногих центрах.
2. Брахитерапия. Брахитерапия основана на использовании временных имплантов с высокой активностью (125I) и применялась при глиомах высокой степени злокачественности при рецидиве или первичном лечении. Однако результаты не подтвердили эффективность брахитерапии. Импланты также применялись для лечения глиом низкой степени злокачественности, а иридиевая проволока в качестве паллиативного средства при глиобластоме.
3. Терапия методом захвата нейтронов бором. Терапия методом захвата нейтронов бором заключается в захвате и взаимодействии нейтронов с очень низкой энергией (тепловой) или с низкой энергией (эпитермальной) стабильным изотопом бора-10 (10В). Захват вызывает распад 10В и высвобождение а-частиц и частиц лития.
N + 10В -» 4Не + 7Li
Успех методики заключается в селективном накоплении 10В в опухоли при использовании меченых соединений бора, таких как 10B-BSA. Пучок низкоэнергетических нейтронов с высокой линейной энергетической передачей (LET) обладает малым рассеиванием около опухоли. Это метод изучается в нескольких центрах мира.
ж) Будущее лучевой терапии ЦНС. Лучевая терапия — один из основных методов лечения у больных с различными опухолями ЦНС, особенно злокачественными. Это положение будет сохраняться и в обозримом будущем. Тем не менее, мы приближаемся к пределу, за которым технические улучшения доставки излучения дают небольшие дополнительные преимущества. Перспектива совершенствования методов возникнет на основе нашего лучшего понимания механизмов контролирования клеточного цикла и реагирования на радиационное облучение.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
– Также рекомендуем “Схема химиотерапии опухоли головного мозга – Европейские протоколы”
Оглавление темы “Нейрохирургия опухоли головного мозга.”:
- Схема лучевой терапии опухоли головного мозга – Европейские рекомендации
- Схема химиотерапии опухоли головного мозга – Европейские протоколы
- Схема адъювантного лечения опухоли мозга у ребенка – Европейские рекомендации
- Схема адъювантной терапии злокачественной глиомы головного мозга у ребенка – Европейские рекомендации
- Схема адъювантной терапии медуллобластомы у ребенка – Европейские рекомендации
- Схема адъювантной терапии эпендимомы у ребенка – Европейские рекомендации
- Новые методы лечения опухоли головного мозга и их эффективность
- Алгоритм диагностики аневризмы сосуда головного мозга – Европейские рекомендации
Источник
