Отек костного мозга бедренной кости и большеберцовой

Автор Хусаинов Руслан Халилович На чтение 5 мин. Опубликовано 08.12.2016 22:22 Обновлено 23.01.2018 09:55
Большинство людей знакомы с кровоподтеками, которые происходят при травме мышц и мягких тканей. Тем не менее, не все знают, что у костей также могут быть гематомы.
Ушибы костной ткани является серьезными и болезненными травмами, которые обычно проходят в течение нескольких месяцев, хотя при ушибах крупных костей это может занять еще больше времени.
 (с) wiseGEEK: clear answers for common questions
(с) wiseGEEK: clear answers for common questions
Что такое гематома?
Гематома образуется тогда, когда при ударе кровеносный сосуд разрывается близко от поверхности кожи. При этом небольшое количество крови попадает в ткани под кожу. Область удара приобретает вначале красный цвет, а затем становится синей или фиолетовой, зеленой и желто-коричневого цвета, а когда синяк заживает, кожа становится нормального цвета.
Кровоподтеки могут произойти не только под кожей, но и глубоко в тканях, органах и костях. Глубокие ушибы не имеют видимых признаков кровотечения, ушиб может вызвать сильную боль.
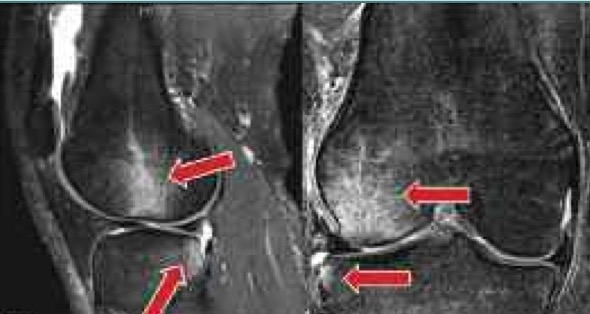
В 1988 году ученые обнаружили состояние, которое назвали отеком костного мозга. Было установлено, что у людей с болью в тазобедренном и коленном суставе изменялась плотность костного мозга на магнитно-резонансной томографии (МРТ), этого не было видно при рентгене.
Отек костного мозга в настоящее время называют «ушибом кости», чтобы отразить травматическую природу этого состояния. Ушиб костей также иногда называют контузией или гематомой кости.
Изменения костного мозга костей может быть вызвано следующими причинами:
Кровенаполнение приводит к застою кровотока и вызывает тяжелое воспаление.
Жидкость внутри кости. При мышечных травмах жидкость накапливается в мышцах и вызывает отек. Кости не способны разбухать, вместо этого жидкость в костях создает давление, что приводит к боли.
Реактивная гиперемия – это происходит, когда поток крови увеличивается после временной остановки.
Перелом: может быть небольшая трещина в слое кости, чуть ниже хряща в суставе.
Трабекулы – это перегородки, которые поддерживают фиброзные ткани в кости. Полный перелом кости означает, что все костные трабекулы в этой конкретной области кости повреждены, что вызывает разрыв. Кровоизлияние костей часто описывается как стадия до перелома. В этом случае только некоторые из трабекул нарушаются.
Симптомы отек костного мозга
- Боль, которая сохраняется даже после исчезновения гематомы;
- Припухлость;
- Изменение цвета кожи;
- Боль в суставах вблизи зоны воздействия;
- Воспаление суставов;
- Тугоподвижность суставов.
Боли, связанные с ушибом кости, длятся дольше, чем при травме мягких тканей.
Классификация гематомы костей
Различают три вида гематомы кости:
- Поднадкостничная гематома – кровь накапливается под волокнистой мембраной, которая покрывает поверхность кости;
- Межкостная гематома, включающая кровотечение и отек в центральной полости кости, где находится красный и желтый костный мозг;
- Субхондральная поражение – кровотечение и отек происходят между хрящом и костью внизу.
Тип ушиба кости зависит от того, где происходит повреждение.
Поднадкостничная гематома в основном происходит после травматического удара по кости. Это часто встречается в нижних отделах тела.
Межкостная гематома происходит при регулярных травмах. Этот тип ушиба в основном встречается у футболистов, баскетболистов и бегунов.
Субхондральное поражение вызывается сжимающей силой. Этот тип ушиба костей чаще встречается в футболе и баскетболе.
Прыжки на твердых поверхностях могут вызвать все три типа гематомы костей.
Симптоматика отек костного мозга
Отек костного мозга часто наблюдается в коленном суставе, запястье, пяточной кости, лодыжке и бедре. Они часто происходят при спортивных травмах, падении, автомобильных авариях или при ударе. Костные гематомы также могут быть вызваны заболеваниями, такими как артрит.
Человек может быть подвержен риску костной гематомы, если он:
- Принимает участие в спортивных мероприятиях;
- Имеет тяжелую физическую работу;
- Не носит защитное снаряжение для спорта или для работы;
- Если у него есть остеоартрит.
Диагностирование ушиба костей
 (с) Lower Extremity Review Magazine
(с) Lower Extremity Review Magazine
Важно обратиться к врачу, если есть подозрение на отек костного мозга, так как это может вызвать серьезные проблемы. Врач может провести медицинский осмотр травмированной области, и если есть подозрение на гематому кости, то назначают МРТ.
Лечение отека костного мозга
Костную гематому можно лечить с помощью покоя, льда и болеутоляющих препаратов.
Врач может предложить:
- Покой травмированной конечности;
- Уменьшение отека за счет поднятия травмированной конечности выше уровня сердца;
- Применение льда несколько раз в день;
- Лекарственные средства, чтобы уменьшить боль и воспаление;
- Ношение бандажа, чтобы ограничить движение.
Важно избегать постоянного или сильного давления или тяжелого веса на пораженный участок. Если кость или сустав не имеет достаточного отдыха, процесс заживления может замедлиться и может произойти больше повреждений.
Необходимо поддерживать диету, богатую кальцием, витамином D и белком. Курение может задержать заживление кости.
Большинство ушибов костей заживают в течение нескольких месяцев. В редких случаях при отсутствии кровоснабжения может произойти асептический некроз кости. Если кость умирает, то повреждения необратимы.
В то время как ушибы костей не всегда можно предотвратить, сбалансированное питание, регулярные физические упражнения, отказ от курения, ограничение потребления алкоголя и использование защитных приспособлений во время занятия спортом помогут сохранить ваши кости здоровыми.
Список используемой литературы:
- DeAngelis, Joseph P., and Kurt P. Spindler. «Traumatic bone bruises in the athlete’s knee» Sports Health: A Multidisciplinary Approach 2.5 (2010): 398-402.
- Mandalia, V., et al. «Bone bruising of the knee» Clinical radiology 60.6 (2005): 627-636.
- Mandalia, V., and J. H. L. Henson. «Traumatic bone bruising-A review article» European journal of radiology 67.1 (2008): 54-61.
- Patel, Sonika A., et al. «Prevalence and location of bone bruises associated with anterior cruciate ligament injury and implications for mechanism of injury: a systematic review» Sports Medicine 44.2 (2014): 281-293.
- Wilson, A. J., et al. «Transient osteoporosis: transient bone marrow edema?» Radiology 167.3 (1988): 757-760.
Понравилась новость? Читайте нас в Facebook
Источник
Отек костного мозга и отек спинного мозга, несмотря на схожесть названия, возникают вследствие различных причин, возникающие клинические симптомы и последствия совершенно различны, соответственно, лечение будет иметь кардинальные отличия. Поэтому следует различать эти две большие группы нарушений и рассматривать их отдельно.
Поражение костного мозга
Костный мозг получил свое название вследствие важности его функций, хотя никакого отношения к нервной системе он не имеет. Эта субстанция расположена внутри костной ткани и выполняет одну из важнейших функций в человеческом организме – кроветворную. Костный мозг подразделяется на два вида: желтый и красный. Красный костный мозг отвечает в человеческом организме за развитие всех главных клеток крови: лейкоцитов, эритроцитов, тромбоцитов. Желтый выполняет вспомогательную функцию. У детей преобладает красный костный мозг, у взрослых- желтый.

Другая важная функция костного мозга – это сохранение стволовых клеток, своеобразных универсальных предшественников всех видов тканей человеческого организма. Находясь внутри костей, мозг принимает непосредственное участие в питании и росте кости. Наибольшее количество костного мозга располагается в длинных трубчатых костях, грудине, тазовом кольце.
Учитывая анатомо-функциональные особенности этого органа, становится понятным, что отек костного мозга неразрывно связан нарушением внутренней костной структуры (трабекулярный отек), с повреждением сустава (чаще коленного) или всей кости (чаще бедренной или большеберцовой).
Бедренная кость
В результате травматического нарушения целостности большеберцовой или бедренной кости развивается отек костного мозга. Человек ощущает не специфические симптомы травматического происхождения, такие как боль, кровотечение, ощущение распирания в кости.
Специфические признаки при повреждении бедренной кости – это нарушение опорной функции ноги, поворот всей ноги в наружную сторону. Симптомы повреждения большеберцовой кости – это ощущение сильной боли ниже коленного сустава, отечность и невозможность опереться на ногу.
Коленный сустав
Наиболее часто среди всех суставов регистрируются повреждения коленного сочленения в результате ДТП, спортивных нагрузок, падения с высоты. Нередко повреждение коленного соединения сочетаются с внутрисуставными повреждениями бедренной и большеберцовой кости. В детском возрасте нередко встречается так называемый субхондральный перелом сустава – повреждение участка кости, который располагается непосредственно под суставной поверхностью.

Острые симптомы при повреждении этих костей и сустава крайне неприятны, но еще большее значение имеют последствия. Нередко это ограничение подвижности коленного сустава, уменьшение длины бедренной кости и хромота. Отек костного мозга может спровоцировать снижение его функции, то есть уменьшение кроветворения. Это проявляется серьезными нарушениями функций всего человеческого организма: снижением иммунитета, повышенной кровоточивостью. Лечение нарушенных функций кроветворения достаточно сложное, включает системные глюкокортикоиды, кровоостанавливающие средства.
Другие кости
Отек костного мозга может встречаться и при повреждении других костей, где содержится меньший его объем. Поэтому клинические симптомы и последствия менее заметны. Редко развивается так называемый трабекулярный отек мозга кости: при локальных травмах с нарушением только внутренней структуры кости.
К сожалению, лечение собственно отека костного мозга достаточно затруднительно вследствие сочетания этого синдрома с другими поражениями.
Поражение спинного мозга
Отек спинного мозга – это реактивный процесс, который возникает при травмах позвоночника, опухолевых новообразованиях, нарушениях кровообращения. Локальный отек может наблюдаться при смещении позвонков только в месте расположения сместившегося позвонка. Значительно чаще развивается отек всего спинного мозга либо в месте его повреждения и нижележащих отделах.
Проявления
Симптомы повреждения позвоночника достаточно схожи вне зависимости от вызвавшей их причины. Человек ощущает что «отнялись руки или и ноги», сильные боли ниже места повреждения или, наоборот, отсутствие всякой чувствительности.
Чем выше место повреждения позвоночника, тем более тяжелое состояние человека, тем большие нарушения функций наблюдаются. Если поврежден шейный отдел позвоночника, нарушения охватывают и верхние и нижние конечности. Если грудной, то в процесс вовлекаются часть туловища и ноги. Если поврежден поясничный отдел, то наблюдается паралич только нижних конечностей.
В первое время после повреждения преобладают явления атонии. Отечные ткани сдавливают нервные стволы, что еще больше ухудшает состояние человека. Параличи имеют вялый характер («рука напоминает висящую плеть»), рефлексы не вызываются, любые виды чувствительности отсутствуют. Функции тазовых органов глубоко нарушены: человек не может управлять опорожнением мочевого пузыря и прямой кишки. Отмечается полная задержка мочи и кала, иногда моча каплями вытекает из переполненного мочевого пузыря.

В дальнейшем атонические симптомы сменяются спастическими, то есть наблюдается спазм сосудов и мышечной ткани. Отек спинного мозга постепенно уменьшается, последствия сдавления нервных корешков подвергаются обратному развитию. Ткани становятся бледными, отечными, но твердыми на ощупь; в месте соприкосновения с кроватью возникают и быстро увеличиваются пролежни. Нарушения функции тазовых органов проявляются недержанием мочи и кала.
Терапия
Лечение отека спинного мозга является составляющей терапии основного заболевания. Оно должно быть достаточно интенсивным, чтобы уменьшить возможные последствия повреждения позвоночника.
Хирургическое лечение показано только в случае травматического или опухолевого процесса, когда возникает необходимость удалить новообразование или костные отломки, чтобы уменьшить сдавливание и отек спинного мозга. Операции достаточно трудоемки и требуют большого мастерства и внимательности врача.
Медикаментозное лечение комплексное, включает множество препаратов:
- уменьшающих болевой синдром (эффективны наркотические анальгетики – трамадол, кетанов);
- улучшающие сосудистый кровоток (например, трентал, актовегин);
- усиливающие метаболизм в нервной ткани (витамины группы В).
К сожалению, далеко не всегда лечение различных вариантов повреждений позвоночника имеет достаточную результативность. Если отек постепенно исчезает полностью (под влиянием лечения или просто с течением времени), то нарушения собственно структуры мозга восстановлению не подлежат.
Человек на всю оставшуюся жизнь остается с параличами конечностей и нарушениями тазовых органов, эффективное лечение которых не разработано.
Источник
1. Кабалык М.А. Распространенность остеоартрита в России: региональные аспекты динамики статистических показателей за 2011- 2016 гг. Научно-практическая ревматология. 2018;56(4):416-422. doi: 10.14412/1995-4484-2018-416-422. Kabalyk M.A. Prevalence of osteoarthritis in Russia: regional aspects of trends in istical parameters during 2011-2016. Nauchnoprakticheskaya revmatologiya = Rheumatology Science and Practice. 2018;56(4):416-422. (In Russ.) doi: 10.14412/1995-4484-2018-416-422.
2. Neogi T., Zhang Y. Epidemiology of OA. Rheum Dis Clin North Am. 2013;39(1):1-19. Available at: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3545412/
3. Woolf A.D., Pfleger B. Burden of major musculoskeletal conditions. Bull World Health Organ. 2003;81(9):646-656. Available at: https://www.ncbi.nlm.nih.gov/pubmed/14710506.
4. Runhaar J., Zhang Y. Can we prevent OA? Epidemiology and public health insights and implications. Rheumatology. 2018;57(Suppl4):iv3-iv9. doi: 10.1093/rheumatology/key014.
5. Каратеев А.Е., Лила А.М. Остеоартрит: современная клиническая концепция и некоторые перспективные терапевтические подходы. Научно-практическая ревматология. 2018;56(1):70-81. Режим доступа: https://rsp.ima-press.net/rsp/article/view/2502. Karateev A.E., Lila A.M. Osteoarthritis: current clinical concept and some promising therapeutic approaches. Nauchno-Prakticheskaya Revmatologiya = Rheumatology Science and Practice. 2018;56(1):70-81 (In Russ.) Available at: https://rsp.ima-press.net/rsp/article/view/2502.
6. Loeser R.F., Goldring S.R., Scanzello C.R., Goldring M.B. Osteoarthritis: A disease of the joint as an organ. Arthritis Rheum. 2012;64(6):1697-1707. Available at: https://www.scirp.org/reference/ReferencesPapers.aspx?ReferenceID=2235058.
7. Rowbotham E.L., Grainger A.J. Magnetic Resonance Imaging of Arthritis of the Knee. Semin Musculoskelet Radiol. 2017.21(2):113- 121. doi: 10.1055/s-0037-1599213.
8. Costa-Paz M., Muscolo D., Ayerza M., Makino A., Aponte-Tinao L. Magnetic resonance imaging follow-up study of bone bruises associated with anterior cruciate ligament ruptures. Arthroscopy. 2001;17(5):445-449. doi: 10.1053/jars.2001.23581.
9. Rosenberg J.H., Rai V., Dilisio M.F., Agrawal D.K. Damage-associated Molecular Patterns in the Pathogenesis of Osteoarthritis: Potentially Novel Therapeutic Targets. Mol Cell Biochem. 2017;434(1-2):171-179. doi: 10.1007/s11010-017-3047-4.
10. Boks S.S., Vroegindeweij D., Koes B.W., Hunink M.G.M., Bierma-Zeinstra S.M.A. Follow-up of occult bone lesions detected at MR imaging: Systematic review. Radiology. 2006;238:853-862. doi: 10.1148/radiol.2382050062.
11. Zanetti M., Bruder E., Romero J., Hodler J. Bone marrow edema pattern in osteoarthritic knees: Correlation between MR imaging and histologic findings. Radiology. 2000;215:835-840. doi: 10.1148/radiology.215.3.r00jn05835.
12. Felson D.T., McLaughlin S., Goggins J., LaValley M.P., Gale M.E., Totterman S., et al. Bone marrow edema and its relation to progression of knee osteoarthritis. Ann Intern Med. 2003;139:330-336. doi: 10.7326/0003-4819-139-5_part_1-200309020-00008.
13. Hunter D.J., Zhang Y., Niu J., Goggins J., Amin Sh., LaValley M.P., et al. Increase in bone marrow lesions associated with cartilage loss. Arthritis Rheum. 2006;54(5):1529-1535. doi: 10.1002/art.21789.
14. T., Steinbach L., Ghosh S., Ries M., Ying Lu, Lane N., Majumdar Sh. Osteoarthritis: MR imaging findings in different stages of disease and correlation with clinical findings. Radiology. 2003;226:373-381. Available at: doi: 10.1148/radiol.2262012190.
15. Kornaat P.R., Bloem J.L., Ceulemans R.T., Riyazi N., Rosendaal F.R., Nelissen R.G. Osteoarthritis of the knee: association between clinical features and MR imaging findings. Radiology. 2006;239:811-817. doi: 10.1148/radiol.2393050253.
16. Aigner N., Meizer R., Meraner D., Becker S., Radda C., Landsiedl F. Tapping test in patients with painful bone marrow edema of the knee. Clin J Pain. 2008;24(2):131-134. doi: 00002508-200802000-00007.
17. Bergman A.G., Willen H.K., Lindstrand A.L., Petterson H.T. Osteoarthritis of the knee; correlation of subchondral MR al abnormalities with histopathologic and radiographic features. Skelet Radiol. 1994;23(6):445-448.doi: 10.1007/BF00204605.
18. Thiryayi W.A., Thiryayi S.A., Freemont A.J. Histopathological perspective on bone marrow oedema reactive bone change and haemorrhage. Eur J Radiol.2008;67(1):62-67. doi: 10.1016/j.ejrad.2008.01.056.
19. Starr A.M., Wessely M.A., Albastaki U., Pierre- Jerome C., Kettner N.W. Bone marrow edema: pathophysiology, differential diagnosis, and imaging. Acta Radiol. 2008;49(7):771-786. doi: 10.1080/02841850802161023.
20. Klement M.R., Sharkey P.F. The ificance of Osteoarthritis-associated Bone Marrow Lesions in the Knee. J Am Acad Orthop Surg. 2019;27(20):752-759. doi: 10.5435/JAAOS-D-18-00267.
21. Crema M.D., Roemer F.W., Zhu Y., Marra M.D., Niu J., Zhang Y., et al.` Subchondral cystlike lesions develop longitudinally in areas of bone marrow edema-like lesions in patients with or at risk for knee osteoarthritis: detection with MR imaging – the MOST study. Radiology. 2010;256(3):855-862. doi: 10.1148/radiol.10091467.
22. Scher C., Craig J., Nelson F. Bone marrow edema in the knee in osteoarthrosis and association with total knee arthroplasty within a three-year follow-up. Skeletal Radiol. 2008;37(7):609-617. doi: 10.1007/s00256-008-0504-x.
23. Garnero P., Peterfy C., Zaim S., Schoenharting M. Bone marrow abnormalities on magnetic resonance imaging are associated with type II collagen degradation in knee osteoarthritis: a three-month longitudinal study. Arthritis Rheum. 2005;52(9):2822-2829. doi: 10.1002/art.21366.
24. Perry T.A., Parkes M.J., Hodgson R., Felson D.T., O’Neill T.W., Arden N.K. Effect of Vitamin D supplementation on synovial tissue volume and subchondral bone marrow lesion volume in symptomatic knee osteoarthritis. BMC Musculoskelet Disord. 2019;20(1):76. doi: 10.1186/s12891-019-2424-4.
25. Laslett L.L., Doré D.A., Quinn S.J., Boon P., Ryan E., Winzenberg T.M., Jones G. Zoledronic acid reduces knee pain and bone marrow lesions over 1 year: a randomised controlled trial. Annals of the Rheumatic Diseases. 2012;71:1322-1328. doi: 10.1136/annrheumdis-2011-200970.
26. Varenna M., Zucchi F., Failoni S., Becciolini A., Berruto M. Intravenous neridronate in the treatment of acute painful knee osteoarthritis: a randomized controlled study. Rheumatology. 2015;54(10):1826-1832. doi: 10.1093/rheumatology/kev123.
27. Cai G., Laslett L.L., Aitken D., Cicuttini F., March L., Hill C., Winzenberg T., Jones G. Zoledronic acid plus methylprednisolone versus zoledronic acid or placebo in symptomatic knee osteoarthritis: a randomized controlled trial. Ther Musculoskelet Dis. 2019;11:1759720X19880054. DOI: 10.1177/1759720X19880054.
28. Kraenzlin M.E., Graf C., Meier C., Kraenzlin C., Friedrich N.F. Possible beneficial effect of bisphosphonates in osteonecrosis of the knee. Knee Surg Sports Traumatol Arthrosc. 2010;18(12):1638-1644. doi: 10.1007/s00167-010-1106-4.
29. Meier C., Kraenzlin C., Friederich N.F., Wischer T., Grize L., Meier C.R., Kraenzlin M.E. Effect of ibandronate on spontaneous osteonecrosis of the knee: a randomized, double-blind, placebo- controlled trial. Osteoporos Int. 2014;25(1):359-366. doi: 10.1007/s00198-013-2581-5.
30. Mayerhoefer M.E., Kramer J., Breitenseher M.J., Norden C., Vakil-Adli A., Hofmann S., Meizer R., et al. MRI-demonstrated outcome of subchondral stress fractures of the knee after treatment with iloprost or tramadol: observations in 14 patients. Clin J Sport Med. 2008;18(4):358-362. doi: 10.1097/JSM.0b013e31817f3e1c.
31. Baier C., Schaumburger J., Gotz J., Heers G., Schmidt T., Grifka J., Beckmann J. Bisphosphonates or prostacyclin in the treatment of bone-marrow oedema syndrome of the knee and foot. Rheumatol Int. 2013;33(6):1397-1402. DOI: 10.1007/s00296-012-2584-0.
32. Kumagai K., Shirabe S., Miyata N., Murata M., Yamauchi A., Kataoka Y., Niwa M. Sodium pentosan polysulfate resulted in cartilage improvement in knee osteoarthritis – an open clinical trial. BMC Clin Pharmacol. 2010;10:7. doi: 10.1186/1472-6904-10-7.
33. Ghosh P., Edelman J., March L., Smith M. Effects of pentosan polysulfate in osteoarthritis of the knee: a randomized, double-blind, placebo-controlled pilot study. Curr Ther Res Clin Exp. 2005;66(6):552-571. doi: 10.1016/j.curtheres.2005.12.012.
34. Sampson M.J., Kabbani M., Krishnan R., Nganga M., Theodoulou A., Krishnan J. Improved clinical outcome measures of knee pain and with concurrent resolution of subchondral Bone Marrow Edema Lesion and joint effusion in an osteoarthritic patient following Pentosan Polysulphate Sodium treatment: a case report. BMC Musculoskelet Disord. 2017;18(1):396. doi: 10.1186/s12891-017-1754-3.
35. Sunaga T., Oh N., Hosoya K., Takagi S., Okumura M. Inhibitory effects of pentosan polysulfate sodium on MAP-kinase pathway and NF-kappaB nuclear translocation in canine chondrocytes in vitro. J Vet Med Sci. 2012;74(6):707-711. doi: 10.1292/jvms.11-0511.
36. Troeberg L., Mulloy B., Ghosh P., Lee M.H., Murphy G., Nagase H. Pentosan polysulfate increases affinity between ADAMTS-5 and TIMP- 3 through formation of an electroically driven trimolecular complex. Biochem J. 2012;443(1):307-315. doi: 10.1042/BJ20112159.
37. Ghosh P., Cheras P.A. Vascular mechanisms in osteoarthritis. Best Pract Res Clin Rheumat. 2001;15(5):693-709. doi: 10.1053/berh.2001.0188.
38. Ghosh P. The pathobiology of osteoarthritis and the rationale for the use of pentosan polysulfate for its treatment. Semin Arthritis Rheum. 1999;28(4):211-267. doi: 10.1016/S0049-0172(99)80021-3.
39. Nielsen F.K., Boesen M., Jurik A.G., Bliddal H., Nybing J.D., Ellegaard K., et al. The effect of intra-articular glucocorticosteroids and exercise on symptoms and bone marrow lesions in kneeosteoarthritis: a secondary analysis of results from a randomized controlled trial. Osteoarthritis Cartilage. 2018;26(7):895-902. doi: 10.1016/j.joca.2018.02.900.
40. McAlindon T.E., LaValley M.P., Harvey W.F., Price L.L., Driban J.B., Zhang M., Ward R.J. Effect of intraarticular triamcinolone vs saline on knee cartilage volume and pain in patients with knee osteoarthritis: A randomized clinical trial. JAMA.2017;317(19):1967-1975. doi: 10.1001/jama.2017.5283.
41. Wildi L.M., Raynauld J., Martel-Pelletier J., Beaulieu A., Bessette L., Morin F., et al. Chondroitin sulphate reduces both cartilage volume loss and bone marrow lesions in knee osteoarthritis patients starting as early as 6 months after initiation of therapy: a randomised, double-blind, placebo-controlled pilot study using MRI. Annals of the Rheumatic Diseases. 2011;70(6):982-989. doi: 10.1136/ard.2010.140848.
Источник
